Коррозионные аспекты использования растворов гипохлоритов и озона для дезинфекции сооружений водоснабжения
УДК 628.113
Проведены эксперименты по определению коррозии различных дезинфицирующих средств, таких как гипохлориты натрия и кальция, и озона на стали при дезинфекции внутренней поверхности очистных сооружений. Для экспериментов использовались 50, 150 и 250 мг/л активных растворов хлора для гипохлоритов и 30 и 45 минут введения озона при концентрации его в газовой смеси 0,75 г/м3. Все решения были сделаны на основе искусственной водопроводной воды. Коррозионная скорость стали была исследована электрохимическими методами, такими как потенциал открытого контура и потенциодинамический анализ, а также прямыми измерениями потери массы. Результаты исследований показали, что с точки зрения коррозии дезинфекция внутренней поверхности сооружений водоснабжения озоном предпочтительнее по сравнению с использованием гипохлоритов.
Ключевые слова: водоснабжение, сталь, дезинфекция, гипохлорит, озон, коррозия
Дезинфекция внутренней поверхности сооружений водоподготовки используется для инактивации патогенов и других микроорганизмов и вирусов. Для дезинфекции используются ультрафиолет, озон, хлорсодержащие дезинфицирующие вещества и др. Для дезинфекции в системе водоподготовки широкое применение нашли хлорсодержащие реагенты, такие как хлорамин, хлорная известь и гипохлориты кальция и натрия. Рекомендуемые концентрации хлорсодержащих веществ, согласно рекомендациям, приведенным в нормативных документах различных стран, составляют 25-250 мг/л активного хлора. При этом время обработки сооружений составляет 6-24 часа, и если результаты анализа не являются удовлетворительными, обработку следует повторить с двойным превышением концентрации активного хлора либо времени обработки.
В воде гипохлорит натрия (NaClO) гидролизуется до хлорноватистой кислоты (HClO) в соответствии с реакцией:
NaClO + H2O ↔ Na+ + HClO + OH─
Кинетика установления равновесия гипохлоритов натрия и кальция при концентрациях 50–250 мг/л активного хлора представлена на рис. 1.
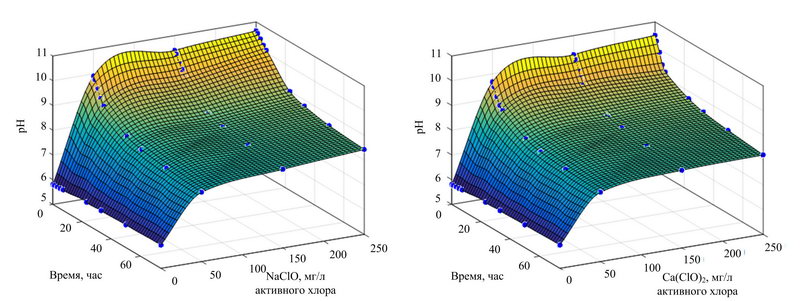
Из представленных данных видно, что равновесие достигается после 24 часов. Соотношение Cl2 / HClO / ClO– зависит от рН и температуры. Гипохлоритный анион преобладает в диапазоне рН более 8. Скорость его деструкции зависит от концентрации активного хлора и температуры. Для водного раствора гипохлорита натрия с концентрацией активного хлора 5% мас. период полураспада составляет 5000 дней при 15°С; 790 дней при 25°C; 13,5 дней при 60°C; 0,25 дней при 100°C.
В 2005 году запатентован метод дезинфекции внутренней поверхности трубопроводов озоном [2]. Согласно предлагаемому способу дезинфекция трубопроводов осуществляется путем обработки их внутренней поверхности дезинфицирующим раствором, полученным путем растворения озона в питьевой воде. С 2012 года ведутся разработки различных вариантов технологий дезинфекции сооружений водоподготовки [2-5]. Также изучаются технические [3-5], экономические [6] и экологические [7] аспекты их использования.
Использование озона для дезинфекции исключает необходимость дезактивации раствора после использования, например, дехлорирования, поскольку озон разлагается в воде в течение короткого периода времени, обычно менее 1 часа. Скорость распада зависит от температуры воды, рН, концентрации озона, содержания веществ в воде.
Значительная часть структур и сетей водоснабжения состоит из металлических деталей, таких как водяные скважины, фильтры, трубопроводы, клапаны. Анализ 10 образцов сталей, взятых из обсадных труб водозаборных скважин показывает содержание углерода в них 0,1-0,46 мас.%, кремния 0,01-0,32 мас.%, марганца 0,29-0,65 мас.%.
Поскольку озон является сильным окислителем, для технического обоснования его использования, для дезинфекции внутренней поверхности сооружений водоснабжения, важно также сравнить его коррозионную активность с хлорсодержащими дезинфицирующими веществами.
Анализируя информацию, представленную в существующих статьях по данной тематике, можно сделать вывод о том, что в настоящее время нет исследований, позволяющих в сопоставимых условиях анализировать коррозионный эффект дезинфицирующих растворов на металлических поверхностях водоочистных сооружений и оправдывать выбор лучшего из них. Очень мало исследований, связанных с коррозионной активностью в растворах активного хлора и растворенном озоне в грунтовых водах. Нет данных о коррозионной активности озона в питьевой воде без добавок.
Материалом для исследований в работе была выбрана сталь следующего состава (согласно данным производителя): углерод – 0,060, марганец – 0,220, кремний – 0,010, фосфор – 0,014, сера – 0,014, алюминий – 0,047 мас.% (стандарт: EN 10 130/91, качество: Fe P01 A).
Обработка стали включала шлифовку (абразивная бумага FEPA P 1200 # SiC) и полировку (DP-Nap и dimond DP-Stick P Struers), а затем промывание дистиллированной водой и обезжиривание ацетоном и этанолом, затем и высушивались азотом (> 99,999%).
Исследуемые растворы готовились на основе искусственной питьевой воды согласно ISO 6341 : 2012 с рН 7,5. В качестве дезинфицирующего средства использовали NaClO (содержащий 3,5 г/л активного хлора, Alfa Aesar, Германия) и Ca(ClO)2 (99,95%, содержащий 65% активного хлора, Alfa Aesar, Germany). Эксперименты по коррозии проводились в водных растворах гипохлоритов 50, 150 и 250 мг/л активного хлора.
Для генерации озона использовался генератор озона O341M Environment S.A. с концентрацией озона в выходе 0,75 мг/м3 и расходом 4 л/мин.
Характеристика микроструктуры и поверхность образцов после обработки были исследованы с использованием настольного сканирующего электронного микроскопа (СЭМ) с элементным анализом (Hitachi TM-1000).
Измерения потери массы проводились во времени до 24 часов в зависимости от максимального времени обработки с использованием исследуемых дезинфицирующих средств на 4 параллельных образцах.
Определение ионов железа в растворах проводили с использованием атомно-абсорбционного спектрофотометра (прибор AAnalyst 800, Perkin Elmer) с графитовой печью.
Потеря веса (среднее значение трех параллельных экспериментов) образцов в выбранных средах показана на рис. 2.
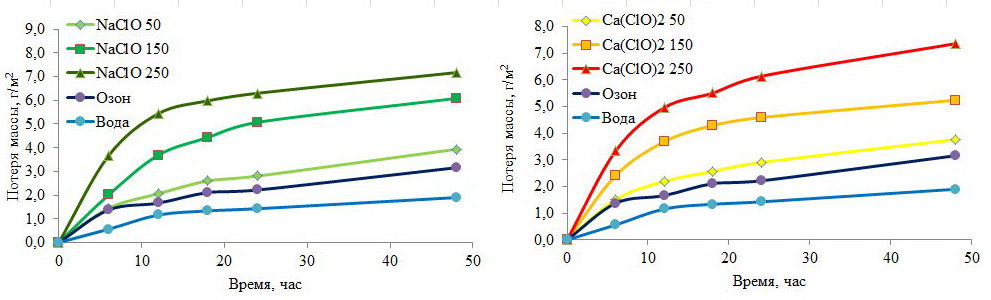
Рис. 2. Потеря массы образцов в исследуемых растворах
Из представленных графиков видно, что потеря массы образцов в гипохлорите натрия и кальция практически одинакова. Несмотря на то, что озон имеет более высокий окислительно-восстановительный потенциал, потеря массы в озонированной воде значительно меньше, чем в образцах гипохлорита натрия и кальция даже при содержании 50 мг/л активного хлора. Через 24 часа скорость коррозии образца в озонированной воде составляет 2,11 мг/м2 , примерно в 2,8 и 2,4 раза меньше, чем в 150 мг/л гипохлорита натрия и кальция соответственно и на 21 и 31% меньше, чем в гипохлоритах натрия и кальция соответственно. В то же время скорость коррозии образца в озонированной воде примерно в 1,5 раза выше, чем в питьевой воде.
После исследования потери массы в течение 24 часов нахождения пластинок в растворах дезинфицирующих веществ пластинки помещались в питьевую воду еще на 24 часа. Результаты потери массы представлены также на рис. 2 (значение 48 часов обработки). Данный эксперимент был направлен на исследование коррозии после процедуры дезинфекции и возможного влияния дезинфицирующих растворов, оставшихся в образовавшихся порах на образцах стали.
Результаты данного исследования показали, что после промывки стальных пластинок в порах остается достаточное количество растворов, приводящих к увеличению рН воды с исходного значения 7,50 до 7,89.
На рис. 3 представлены микрофотографии поверхностей после обработки дезинфицируюшими веществами (в течение 24 часов; 150 мг/л активного хлора или 30 мин обработка озоном) и в качестве сравнения в питьевой воде.

Рис. 3. Микрофотографии поверхности образцов после обработки
Электрохимические испытания проводились путем определения потенциала открытого контура и потенциодинамического анализа. Результаты исследования показали, что для всех растворов потенциал снижается в начальное время обработки и со временем стабилизируется. Время стабилизации зависит от природы и рН раствора. Для питьевой воды и обработанной озоном повышение уровня рН приводит к увеличению времени стабилизации.
В течение первых 3 минут инжекции озона pH воды увеличивается с 7,5 до 7,88. Для 50 мг/л раствора активного хлора время стабилизации намного большее, чем в других исследуемых растворах. Растворы с содержанием активного хлора 150 и 250 мг/л приводят к значительному сокращению времени стабилизации. После стабилизации потенциала наблюдаются его флуктуации в диапазоне ± 20 мВ. Это может быть связано с местной коррозией поверхности стали. Когда поры образуются в результате коррозии, они могут тут же закупориваться образующимися продуктами коррозии, которые уменьшают диффузию иона гипохлорита, таким образом, наблюдается локальная пассивация.
При дальнейшем увеличении времени экспозиции наблюдается общая тенденция к постепенному увеличению потенциала, что объясняется накоплением продуктов коррозии на поверхности стали и препятствием для диффузии окислителя на его поверхность.
Потенциодинамические кривые стали в выбранных растворах, полученные после 24 часов воздействия, показали, что во время обработки растворами гипохлорита 150 мг/л активного хлора наблюдаются наибольшие значения токов коррозии, а также потенциала коррозии, чем для растворов с концентрацией 50 и 250 мг/л активного хлора. Ток во время инжекции озона в 1,7 раза выше, чем в искусственной воде. Прекращение инжекции озона приводит к снижению тока на 30% (с 8,5 до 6,5).
Полученные результаты электрохимических исследований подтверждают, что в процессе дезинфекции озон имеет меньший коррозионный эффект, чем растворы гипохлоритов. Это может быть объяснено тем, что озон образует очень тонкий и плотный слой продуктов коррозии [8-10], который позволяет снизить коррозию стали в сравнении с растворами гипохлоритов.
Традиционный механизм коррозии стали может быть продемонстрирован следующими реакциями:
Анодная реакция:
2Fe + O2 + 2H2O → 2Fe2+ + 4OH– → 2Fe(OH)2
Таким образом, могут образовываться различные виды железосодержащих осадков:
4Fe(OH)2 + O2 → 2H2O + 2Fe2O3·H2O
2Fe(OH)2 + H2O + ½ O2 → 2Fe(OH)3
2Fe(OH)3 + O2 → 2Fe2O3·3H2O + 2H2O
Катодная реакция:
O2 + 2H2O + 4e– → 4OH–
Образование ржавчины на поверхности стали приводит к уменьшению диффузии окислителя к поверхности металла, однако ионы гипохлорита в щелочных средах могут привести к растворению данного слоя
2Fe(OH)3 + 3ClO– + 4OH– → 2FeO42– + 3Cl– + 5H2O
В нейтральной среде ферраты медленно разлагаются
2FeO42– + 10H2O → 4Fe(OH)3 + 3O2 + 8OH–
Также может быть предложена прямая реакция железа с ионами гипохлорита:
Fe + 2ClO– + 2H2O → [Fe(OH)4] – + Cl2
Качественный анализ присутствия ионов железа в растворах после обработки был подтвержден анализом ААС жидкой фазы.
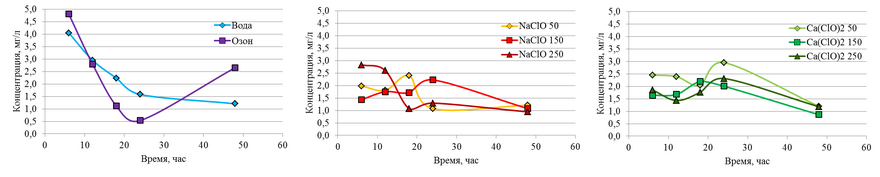
Рис. 4. Содержание ионов железа в растворах дезинфекции
Также следует отметить, что при рН выше, чем нейтральная, Fe3+ в растворах может находится в форме моно- и дигидрокомплексов [(H2O)5Fe(OH)]2+ и [(H2O)4Fe(OH)2]+ [11, 12]. При концентрациях Fe3+ более чем 10–3 моль·л–1 могут образовываться такие продукты как [(H2O)4Fe-(OH)2-Fe(H2O)4]4+ и [(H2O)5Fe-(OH)2-Fe(H2O)5]4+ [13].
Что касается влияния озона, то благодаря абсорбции молекул озона на поверхности стали и дальнейшего их разложения на молекулу кислорода и кислородный радикал [14] происходит формирование тонкой пленки ржавчины [8–10], в отличие от таковой, формируемой гипохлоритами.
Прямое окисление железа непосредственно до Fe2O3:
4Fe + 4O3 → 2Fe2O3 + 3O2
Или участие озона при окислении Fe2+
2Fe2+ + O3 + 5H2O → 2Fe(OH)3 + O2 + 4H+
Из приведенного выше обсуждения легко понять, что использование озона для дезинфекции поверхностей водоочистных сооружений и трубопроводов вызывает меньше коррозии, чем растворов гипохлорита.
Таким образом, полученные данные подтверждают ранее полученные данные [15, 16], что дезинфекция сооружений водоснабжения c использованием озона взамен растворов гипохлоритов приводит к меньшей коррозии стали.
Литература:
1 Schulz C., Lohman S. Method and apparatus for ozone disinfection of water supply pipelines: заяв. пат. 11065768 США. – 2005.
2 Романовский, В.И. Сравнительный анализ эффективности дезинфекции сооружений водоснабжения дезинфицирующими растворами / В.И. Романовский, И.В. Рымовская, С. Янь Фэн // Вода magazine. – 2015. – №10(98). – С. 18–21.
3 Романовский, В.И. Определение основных параметров дезинфекции и обеззараживания озоном сооружений питьевого водоснабжения / В. И. Романовский, В. В. Лихавицкий, М. В. Рымовская, А. Д. Гуринович // Труды БГТУ. – 2015 – № 3 (176): Химия и технология неорган. в-в. – C. 108–112.
4 Романовский, В.И. Технические аспекты использования озона в водоподготовке / В.И. Романовский, А.Д. Гуринович, Ю.Н. Бессонова, Е.В. Крышилович // Вода magazine. – 2016. – №2(102). – С. 36–41.
5 Гуринович, А.Д. Эффективность дезинфекции озоном сооружений систем водоснабжения / А.Д. Гуринович, В.И. Романовский, Ю.Н. Бессонова // Водоочистка. Водоподготовка. Водоснабжение. – 2016. – №10. – С. 48–51.
6 Романовский, В.И. Сравнительный анализ расчета показателей эколого-экономической эффективности способов дезинфекции водозаборных скважин / В.И. Романовский, А.Д. Гуринович // Актуальные вопросы экономики строительства и городского хозяйства: материалы II междунар. науч.-практ. конф., Минск, 23–24 апр., 2013 / Белорусский национальный технический университет; редкол.: С.А. Пелих, В.К. Липский. – Минск, 2014. – С. 300–306.
7 Рымовская, М. В. Воздействие отработанных растворов дезинфекции сооружений водоснабжения на почву / М. В. Рымовская, В. И. Романовский // Труды БГТУ. – 2016 – № 4 (186): Химия и технология орган. в-в. – C. 214–219.
8 Liao J. et al. Effect of ozone on corrosion behavior of mild steel in seawater //Corrosion Science. – 2012. – Т. 55. – С. 205–212.
9 Kuznetsova A. et al. Making a superior oxide corrosion passivation layer on aluminum using ozone //Langmuir. – 2001. – Т. 17. – №. 7. – С. 2146–2152.
10 Toshio S. Increase the Corrosion Resistance of Stainless Steels by Passivation Treatment Using (H2O2 + O3) Solution //Corrosion Engineering. – 2010. – Т. 59. – №. 12. – С. 376-376.
11 Sharma S. K. Adsorptive iron removal from groundwater. – CRC Press, 2001.
12 Brandt C., Van Eldik R. Transition metal-catalyzed oxidation of sulfur (IV) oxides. Atmospheric-relevant processes and mechanisms //Chemical Reviews. – 1995. – Т. 95. – №. 1. – С. 119–190.
13 Cornelis R. et al. Handbook of elemental speciation II: species in the environment, food, medicine and occupational health. – John Wiley & Sons, 2005.
14 Koike K. et al. Ozone passivation technique for corrosive gas distribution system //Japanese journal of applied physics. – 1997. – Т. 36. – №. 12R. – С. 7437.
15 Романовский, В.И. Коррозионная устойчивость углеродистых сталей к дезинфицирующим растворам / В. И. Романовский, Ю. Н. Чайка // Труды БГТУ. – 2014 – № 3 (167): Химия и технология неорган. в-в. – C. 47–50.
16 Романовский, В.И. Коррозионная устойчивость стали 15 к дезинфицирующим растворам / В. И. Романовский, В. В. Жилинский // Труды БГТУ. – 2015 – № 3 (176): Химия и технология неорган. в-в. – C. 29–34.
Corrosion aspects of using hypochlorite and ozone solutions for disinfection of water supply facilities
Experiments were conducted to determine the corrosion rate of different disinfectants such as sodium and calcium hypochlorites and ozone on steel during disinfection of internal surface of water treatment facilities. For experiments were used 50, 150 and 250 mg/L of active chlorine solutions for hypochlorites, and 30 and 45 min injection of ozone. All solutions were made based on artificial tap water. Corrosion rate of steel has been investigated by electrochemical methods such as open-circuit potential and potentiodynamic measurements and weight loss measurements. Results show that the disinfection of internal surface by ozone is preferable to the use of hypochlorites in terms of corrosion.
Keywords: water supply, steel, disinfection, hypochlorite, ozone, corrosion.
Ramanouski Valiantsin Ivanavich, Ph.D. (Engineering), senior lecturer, Department of Industrial Ecology, Belarusian State Technological University, 13a, Sverdlova str., 220050, Minsk, Republic of Belarus. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Per Martin Claesson, Ph.D, Head of the division, professor, Chemistry Department, Division of Surface and Corrosion Science, KTH Royal Institute of Technology, Drottning Kristinas vag. 51, SE-100 44 Stockholm, Sweden. Royal Institute of Technology.
Yolanda Hedberg, Ph.D, Docent, Chemistry Department, Division of Surface and Corrosion Science, KTH Royal Institute of Technology, Drottning Kristinas vag. 51, SE-100 44 Stockholm, Sweden. Royal Institute of Technology.
Romanovskaia Elena Vladimirovna, Ph.D. (Chemistry), lecturer, Department of Chemistry, Technology of Electrochemical Production and Electronic Engineering Materials, Belarusian State Technological University, 13a, Sverdlova str., 220050, Minsk, Republic of Belarus. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Likhavitski Vitaly Viktorovich – assistant, Department of Automation of Production Process and Electrical Engineering. Belarusian State Technological University, 13a, Sverdlova str., 220050, Minsk, Republic of Belarus. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Журнал "Вода Magazine", №9 (133), 2018 г.













