УДК 628.316.12
Ключевые слова: сероводород, сульфиды, сточные воды, удаление сероводорода из воды, технологический процесс.
Наиболее концентрированные по сероводороду сточные воды образуются на заводах по переработке сернистой и высокосернистой нефти (до 60 г/л). От 10 до 1500 мг/л сероводорода присутствует в сточных водах предприятий цветной металлургии. На заводах черной металлургии при грануляции доменного шлака образуются стоки с концентрацией сероводорода до 30 мг/л. Сточные воды производства синтетических жирных кислот содержат до 40 мг/л сероводорода. До 20 мг/л сероводорода входит в состав сточных вод производства искусственного волокна. Сравнительно большие объемы сероводородсодержащих дренажных и пластовых вод образуются при открытой карьерной разработке серных руд, а также при подземной выплавке серы [1]. Указанные воды сильно минерализованы и содержат значительные концентрации сероводорода (около 50-200 мг/л).
Применяемые сегодня в России методы очистки не всегда удовлетворяют с точки зрения экологии и эффективности. Наиболее остро стоит вопрос очистки высококонцентрированных сульфидных вод (концентрация сероводорода более 50 мг/дм).
Повышение требований к защите окружающей среды от промышленных выбросов, ужесточение требований местных органов исполнительной власти в части нормирования качества сточных вод, разрешенных к сбросу в систему бытовой канализации, многомиллионные штрафы, изымаемые с предприятий в виде оплаты экологических рисков за сверхнормативный сброс загрязняющих веществ, - все это ставит проблему концентрированных производственных сульфидных вод как наиболее значимую в перечне экологических рисков, а ее решение - в ряд безотлагательных.
Работы по совершенствованию методов и технологий очистки сероводородных вод ведутся на протяжении уже многих лет. Первым в СССР научным трудом по удалению из воды сероводорода стала монография профессора Дурова С.А. «Очистка питьевой воды от сероводорода» [2], вышедшая в 1935 году в Новочеркасском индустриальном институте им. Серго Орджоникидзе (ныне ЮРГПУ им. М.И. Платова).
Существенный вклад в теорию и практику удаления из воды сероводорода в более поздний период внесли труды А.А. Кастальского, В.Д. Плешакова, С.Н. Линевича, Л.А. Алферовой, Г.Ю. Асса, С.И. Игнатенко, Л.Н. Фесенко, Т.А. Будыкиной и других. Обобщающей работой в этой области знаний стала монография С.Н. Линевича [3].
Из числа составленных различными авторами классификаций методов удаления из воды сероводорода (сульфидов) [3-7] наиболее полной и развернутой представляется классификация, предложенная Л.Н. Фесенко [8] (см. рис. 1).

Согласно этой классификации физико-химические методы удаления сероводорода из воды основаны на выделении из воды молекулярного сероводорода физическими воздействиями без добавления в технологию каких-либо химических реагентов [9]. Сущность воздействий заключается в переводе сероводорода из водной системы в газовую фазу при соответствующих условиях, в числе которых: создание большой поверхности раздела фаз (вариант пленочной дегазации), повышение температуры воды (термическая деаэрация), либо понижение давления до уровня, при котором вода закипает без дополнительного подогрева (вакуумная дегазация) [3, 5].
В водах с рН>8,5 сероводород преимущественно находится в виде сульфида и гидросульфида и для перевода его в молекулярную форму H2S для последующей дегазации необходимо подкисление воды до рН=5 и ниже. Для подкисления сульфидных вод могут быть использованы технические кислоты (серная или соляная в случае очистки природных вод), либо кислые компоненты (СО2, SO2, SO3) в составе искусственных газовых или парогазовых смесей, либо отходящих дымовых газов энергетических установок (в случае очистки производственных сточных вод) [3]. Именно этот процесс реализуется на блоке карбонизации «Салаватнефтеоргсинтез» путем обработки воды свободной углекислотой с отдувкой образующегося молекулярного H2S и последующем сжигании сероводорода на факеле.
При окислении диоксида серы (сернистого ангидрида - SO2) кислородом воздуха на свету образуется серный газ (серный ангидрид - SO3), конечным продуктом окисления которого является аэрозоль серной кислоты в воздухе, растворенной в дождевой воде облаков. Серная кислота, выпадая с осадками, подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека [10]. C другой стороны, отсутствие этапа утилизации серы при данном методе, значительный расход CO2 на карбонизацию СЩС (отношение количества CO2 к количеству СЩС до 100:1), неудовлетворительное качество очищенной на выходе воды (невозврат ее в технологические циклы производства), а также попадание SO2 в атмосферу при сжигании сероводорода вызывает необходимость поиска, изучения и внедрения более совершенных и экологичных технологий обработки данной категории сточных вод.
Еще один негативный фактор физических методов - выбросы сероводорода в атмосферу, предельно допустимая концентрация которого в воздухе населенных мест составляет 0,008 мг/м3 [11].
Химические (реагентные) методы выделения сероводорода и его последующей утилизации в виде серосодержащих осадков основаны на окислении сульфидов до элементарной серы (с последующим извлечением ее из воды отстаиванием, фильтрованием, флотацией или другими методами).

Все представленные в таблице реагенты имеют большой удельный расход, многие из них требуют особых мер безопасности при их хранении и использовании. Нетрудно подсчитать, что, например, при концентрации сульфидов в воде 1 г/л расход 0,9%-ного гипохлорита натрия (9 г/л по эквиваленту хлора) составит примерно 1 м3 на 1 м3 сероводородного стока.
Обработка сульфидных вод сернистым газом реализуется в замкнутых технологиях (жидкофазный процесс Клаусса [15]), включающих:
- дегазацию молекулярного сероводорода с сопутствующим окислением его части диоксидом серы до элементарной серы;
- окисление (сжигание) образующихся сероводорода и серы до SO2:
- утилизация и повторное использование в качестве окислителя и подкислителя сульфидной воды.
Однако область применения этого метода ограничивается многостадийностью технологии, необходимостью применения сложного химического оборудования для сжигания H2S и S, а также потреблением жидкого топлива для этих целей.
Способы химического осаждения сероводорода основаны на его свойстве образовывать с большинством металлов нерастворимые в воде сульфиды [16-20]. Образующиеся осадки подлежат либо захоронению, либо переработке. В промышленных масштабах данный метод реализуется путем обработки воды железосодержащими коагулянтами [21-25], в результате чего образуется нерастворимый в воде сульфид железа, осаждаемый в специальных отстойниках.
Методы окисления сероводорода кислородом включают некаталитическое, каталитическое и биохимическое окисление.
При каталитическом методе для активации окисления H2S применяют как гетерогенные, так и водорастворимые катализаторы на основе соединений железа, никеля, хрома, меди, кобальта и других переменновалентных металлов. В частности, реализацию такого метода предлагает группа компаний «Катализ» (г. Ангарск) [26], в котором процесс жидкофазного окисления сульфидов протекает на гетерогенном металлокомплексном катализаторе марки «Катан», загружаемом в колонну в виде трех или пяти секций с нагревом подаваемой воды до 85-90°С. При этом окисление сульфид-ионов осуществляется молекулярным кислородом в координационной сфере иона металла переменной валентности при изменении его валентного состояния. Причем ион металла работает как переносчик электронов с сульфид-ионов на кислород, попеременно восстанавливаясь сульфид-ионом и окисляясь молекулярным кислородом. Тем не менее этот метод ограничен для значительных (граммовых) концентраций сульфидов ввиду необходимости соответствующего количества O2 на окисление сероводорода, что потребует больших количеств катализаторных установок, стоимость которых достаточно велика.
В качестве катализаторов могут выступать и органические соединения. Сероводород, содержащийся в воде, окисляют продувкой воды кислородом или кислородсодержащим газом в присутствии антрахинондисульфокислоты [27]. После окисления воду обрабатывают кислым раствором, отделяют тиосульфат с получением серы и двуокиси серы. Двуокись серы абсорбируют щелочным (или аммиачным) раствором с получением кислого сульфита, а образовавшуюся серу отделяют фильтрованием. При этом не исключается возможность попадания антрахинондисульфокислоты в очищенную воду, что крайне нежелательно даже при малой токсичности реагента.
Для удаления из воды сероводорода может быть использован водный раствор хелата многовалентного металла, выполняющего роль катализатора, в процессе окисления сероводорода кислородом образуется сера [28]. Процесс ведется при непрерывной рециркуляции - очищаемая вода смешивается с большим по объему раствором катализатора предварительно насыщенным кислородом.
Большинство способов каталитического окисления сероводорода кислородом с гомогенным катализатором объединяет один общий недостаток - необходимость применения катализатора, остающегося затем в очищенной воде и безвозвратно теряемого после применения.
Окисление сульфидов возможно осуществлять путем контактирования воды с кислородом при 20-200°С, рН>7 и давлении до 2 МПа без катализатора до тех пор, пока все сульфиды не перейдут в тиосульфаты, а затем в сульфаты [1].
Одним из возможных решений проблемы очистки сероводородных вод является электрохимическое окисление сульфидов [29]. При этом окисление сероводорода на гладких электродах представляет в основном теоретический интерес, поскольку реализовать такой процесс с достаточной скоростью невозможно ввиду низких реальных плотностей тока окисления (0,1-0,2 мА/см2). Использование объемно-пористого анода, например, углеродно-волокнистых материалов, тканого углеграфита и др., позволяет на порядок увеличить токи окисления, чем на гладких электродах с выходом по току, близким к 100%. Продукт окисления сероводорода - элементная сера - удерживается в объеме углеволокна, однако извлечение серы из таких электродов представляет весьма сложную задачу в связи с разрушением волокон при промывке.
Электрохимическое окисление сероводорода в объемно-пористом электроде возможно реализовать и без помощи внешнего источника тока. Для этого загрузка должна обладать электронной проводимостью (электрохимический катализ). При этом твердое тело (токопроводящая загрузка) контактируя с окислителем (O2) и восстановителем (H2S), образует катодные и анодные микроучастки, в которых в любой момент времени будет преобладать концентрация одного из веществ. Это, в свою очередь, приведет к возникновению короткозамкнутых микрогальванических элементов, в результате действия которых и будет окисляться сероводород. Т.е. на поверхности электропроводящего тела (катализатора) происходит разряд ионов HS- и молекул H2S, а освободившиеся в результате окисления HS- и H2S электроны перетекают к участкам катализатора, контактирующего с кислородом, где происходит его восстановление.
Метод электрохимического окисления сероводорода реализуется на каталитической загрузке из природного углеродного материала дробленого антрацита марки Purolat «стандарт», обладающего относительно высокой механической прочностью и производимого из высококачественных низкозольных антрацитов, добываемых на шахте ОАО «Обуховская» (Ростовская область). Наибольшая поверхность контакта сероводорода и кислорода на катализаторе обеспечивается фильтрованием сульфидной воды через незатопленную загрузку из зернистого материала (дробленого антрацита). Такой режим фильтрования известен как метод упрощенной аэрации (сухой фильтрации) при обезжелезивании подземных вод. Рекомендуются следующие оптимальные условия окисления сероводорода: рН=5-8; крупность зерен загрузки 1-3 мм; температура 1-18°С; высота загрузки 50-60 см; скорость фильтрования 1,0-1,5 м/час; полная регенерация загрузки (водовоздушная промывка аналогичная скорым фильтрам) достигается при сероемкости не более 0,5-0,7 кг/м2, содержанием сероводорода до 25 мг/дм3 [30].
Биохимическое окисление сульфидов осуществляется серобактериями [31]. Окисление сероводорода происходит до элементарной серы и затем до серной кислоты.
Интенсификация процесса происходит при нейтрализации щелочным раствором образующейся серной кислоты [32, 33].
Биохимическое окисление высококонцентрированных сульфидных вод нецелесообразно ввиду невысоких скоростей протекания процесса и связанной с этим необходимостью создания больших по объемам сооружений. Кроме того, реализация данного метода сопровождается загрязнением окружающей среды сероводородом.
Рассмотренные выше методы удаления сульфидов из воды в большей или меньшей степени являются высокозатратными, особенно при очистке вод с высоким содержанием сероводорода (более 50 мг/дм3).
Более перспективными решениями по очистке высококонцентрированных сульфидсодержащих вод представляются методы, основанные на связывании сероводорода в нерастворимый сульфид металла. Для организации указанного процесса целесообразно использовать соединения железа, как наименее токсичные, ши> рокоиспользуемые и относительно дешевые реагенты. В этой связи заслуживает внимания метод очистки сероводородных вод, впервые предложенный Д. Андерсеном, Д.П. Козыревым и П.Г. Купцовым [34]. Он основан на связывании сероводорода в нерастворимые сульфиды при добавлении к воде трехвалентного гидроксида железа.
Реакции (3, 4) с образованием сульфида железа FeS и серы протекают в слабокислой и нейтральной средах, реакции (5, 6) с образованием трисульфида железа Fe2S3 - в нейтральной и щелочной. Образующийся сульфид железа отделяют от воды отстаиванием и регенерируют продувкой воздухом.
Как следует из реакций (7, 8), может быть осуществлен замкнутый процесс с многократным использованием одного и того же гидроксида железа путем попеременного его перевода в FeS (или Fe2S3) в Fe(OH)3, параллельно с этим протекают и реакции каталитического окисления сероводорода кислородом воздуха в присутствии железа, которое попеременно принимает двух- и трехвалентное состояние.
При этом железо (II) окисляется опять-таки кислородом воздуха до трехвалентной формы с последующим взаимодействием с сероводородом. Именно это обстоятельство делает весьма заманчивым данный метод в условиях очистки высококонцентрированных сульфидных вод, поскольку реагент находится в обороте.
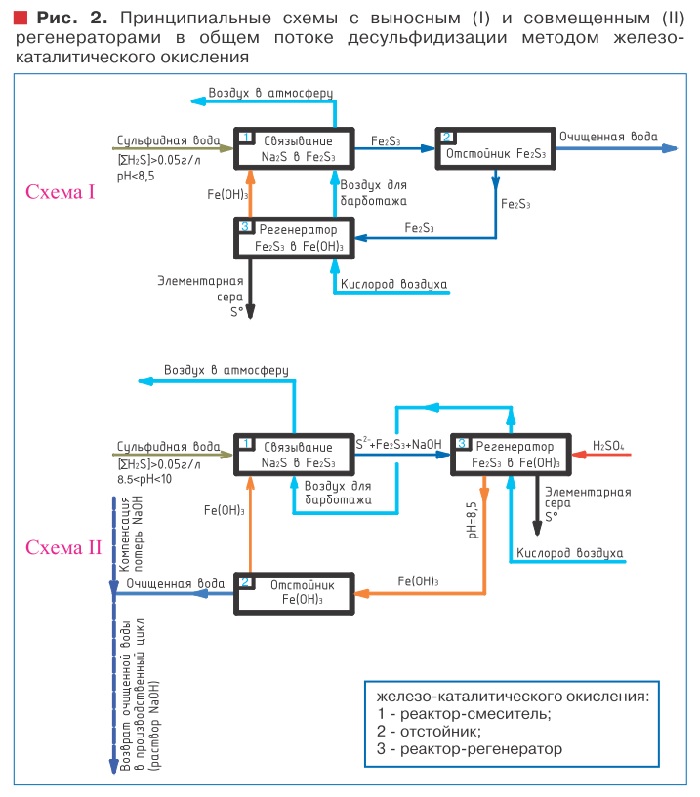
Анализ результатов экспериментально-теоретических и производственных исследований [35-38] указывает, что в производственных условиях метод железо-каталитического окисления сульфидов кислородом воздуха может быть реализован раз личными технологическими схемами, конкурирующими в определенных областях их рационального применения. В зависимости от pH среды очищаемой воды и концентрации сульфидов назначается технологический режим установки очистки.
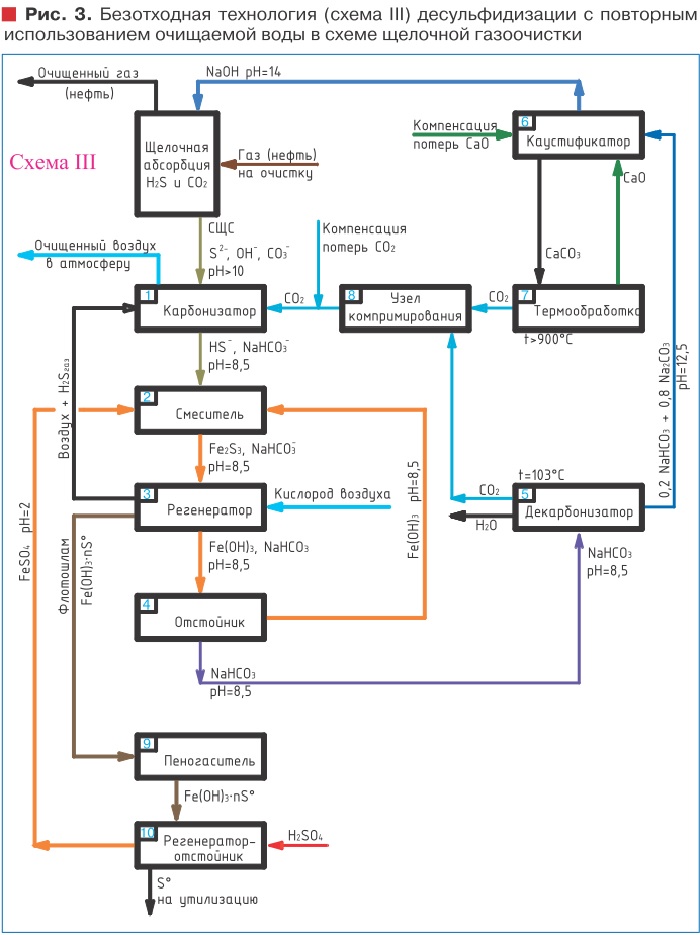
Варианты технологических схем десульфидизации методом железо-каталитического окисления представлены в таблице 2 и на рис. 2, 3, 4.


Концентрация карбонатной щелочности (Щ CO3 ) в больших или равных гидратной (Щ ОН ) концентрациях наблюдается в сернисто-щелочных сточных водах (СЩС) от установок
щелочной абсорбционной очистки углеводородных газов (или пирогаза) от кислых компонентов H 2 S и CO2. В этом случае безотходность технологии со значительно меньшими затратами (в сравнении со схемой III) возможно обеспечить заменой традиционной щелочной очистки углеводородных газов на селективное поглощение H 2 S и CO 2 (схема IV, рис. 4), путем ступенчатого противоточного контактирования газа на первом этапе с водным раствором бикарбоната натрия NaHCO 3 с pH = 7,5-8,5; и на втором - водным раствором карбоната с pH >10.
При этом на первой стадии процесса происходит связывание только сероводорода с образованием гидросульфида натрия NaHS. Содержащийся в пирогазе CO2 в реакцию с NaHCO3 не вступает и проходит через абсорбционную колонну транзитом на вторую ступень, где оставшийся в пирогазе CO2 абсорбируется в устройстве для мокрой очистки (противоточном абсорбере) водным раствором карбоната натрия с образованием бикарбоната.
Разъединяя поглощение сероводорода бикарбонатсодержащим поглотительным раствором на первой стадии процесса и поглощение оставшейся двуокиси углерода щелочным карбонатным раствором на второй, в итоге можно получить два раздельных поглотительных стока - бисульфидного (сернисто-щелочного) и карбонатного, которые более удобны и значительно менее затратные при их последующей очистке и регенерации, в отличие от смеси этих стоков, образующихся при общепринятой едконатровой щелочной очистке пирогаза. Такое новое технологическое решение защищено патентом Российской Федерации на изобретение №2515300 «Способ селективной очистки пирогаза от сероводорода и двуокиси углерода» и включает следующие последовательные операции и сооружения, обеспечивающие полностью безотходный процесс: очищаемый газ, содержащий кислые примеси (H2S и CO2), направляется в абсорбер №1, орошаемый водным раствором гидрокарбоната натрия, где происходит поглощение сероводородного газа с переводом его в водорастворимую форму NaHS.
Образующаяся двуокись углерода уходит с газовым потоком в абсорбер №2, где поглощается раствором карбоната натрия. Из абсорбера №1 отработанный поглотительный раствор, содержащий гидрокарбонат и гидросульфид натрия отводится в реактор 3 с механическим перемешиванием потока, куда дозируется раствор гидроокиси железа Fe(OH)3 из отстойника 4. В результате образуется практически нерастворимая взвесь трисульфида железа. Из реактора 3 отработанный поглотительный раствор с образовавшейся взвесью Fe2S3 (FeS) подается в регенератор 5 (емкость с устройством нижней подачи диспергированного воздуха), где протекает реакция железо-каталитического окисления сульфидов кислородом воздуха с переводом Fe2S3 (FeS) в элементарную серу и гидроокись железа. Элементарная сера S в результате флотации собирается в верхней части регенератора 5 и выводится из технологического цикла в виде серной пены на последующее обезвоживание и доведение до качества товарного продукта. Из регенератора 5 бикарбонатно-карбонатный натриевый раствор, содержащий взвесь гидроксида железа, направляется в отстойник 4, откуда, после отстаивания уплотненный осадок Fe(OH)3 дозируется обратно в технологический цикл связывания сульфидов (в реактор 3), а надосадочная жидкость, содержащая водный раствор смеси би- и карбоната натрия возвращается в абсорбер №1 для поглощения сероводорода, содержащегося в пирогазе.
В абсорбере №2 оставшаяся в пирогазе свободная углекислота поглощается раствором карбоната натрия с переводом в бикарбонат.
Регенерация раствора карбоната осуществляется в отпарной колонне 6 путем термического разложения NaHCO3, в процессе которого при температуре 60-200°С гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду.
Образующийся водяной пар конденсируют и полученную деминерализованную воду используют для разбавления циркулирующего в абсорбере №1 бикарбонатного поглотительного раствора. Получаемый в отпарной колонне 6 раствор карбоната вводится в циркулирующий в абсорбере №2 поток поглотительного раствора взамен удаляемого из него раствора бикарбоната. Выводимый из отстойника 4 избыток пересыщенного по карбонату поглотительного раствора также направляется в отпарную колонну 6, откуда получаемая вода возвращается в поглотитель абсорбера №1, а раствор карбоната - в поглотитель абсорбера №2.
Выводы:
Несмотря на обширный материал исследований, накопленный в области очистки воды от сульфидов, интерес к этой проблеме сохраняется. Окончательный выбор схемы предполагает учет всех особенностей образования и последующего отведения (или повторного применения) очищенных сульфидных вод (область применения метода), их карбонатно-щелочного состава, концентрации сульфидов, а также целесообразности, в том числе экономической, повторного использования очищенной воды (раствора).
В условиях очистки высококонцентрированных сульфидсодержащих вод наиболее перспективным представляется метод железо-каталитического окисления. Определяющим фактором при составлении технологии является химический состав сульфидных вод.
Активная реакция среды (pH) указывает на количество сульфидов, связываемых железом, тем самым определяя направление проведения процесса железо-каталитического окисления по одной из рекомендуемых схем: отделение осадка Fe2S3 (FeS) и его регенерация в гидроксид в выносном регенераторе, устанавливаемым отдельно от основного пока очищаемой воды; или корректировка pH в реакторе-смесителе и регенерация Fe2S3 (FeS) в Fe(OH)3 в основном потоке.
Для создания слабощелочной среды (pH=7,5-8,5), необходимой для протекания реакций (3-6), следует нейтрализовать ионы OH- и перевести карбонатную щелочность в бикарбонатную путем корректировки pH среды методом карбонизации исходной воды свободной углекислотой. Применение карбонизации стабилизирует pH очищаемой воды на уровне 8-8,5 ед., что обеспечивает оптимальные условия проведения железо-каталитического окисления сульфидов кислородом воздуха.
В результате очищенная жидкость представляет собой нейтральный раствор бикарбоната натрия, который при последующем восстановлении гидратной щелочности может быть возвращен в производство на повторное использование, организуя тем самым бессточный, замкнутый технологический процесс.
Для предприятий нефтеоргсинтеза, использующих технологию щелочной абсорбционной очистки углеводородных газов (или пирогаза) от кислых компонентов H2S и CO2, в результате которой образуются сернисто-щелочные сточные воды, характеризующиеся концентрацией карбонатной щелочности (ЩCO3) большей или равной гидратной (ЩОН), предлагается замена традиционной щелочной очистки углеводородных газов на селективное поглощение H2S и CO2 путем ступенчатого противоточного контактирования газа на первом этапе с водным раствором бикарбоната натрия NaHCO3 с pH = 7,5-8,5; и на втором > водным раствором карбонта натрия с pH>10, с организацией замкнутого водооборотного цикла.
Литература:
1. Менковский М. Н. Технология серы [Текст] / М. Н. Менковский, В. Т. Яворский. - Москва : Химия, 1985. - 328 с.
2. Дуров С. А. Очистка питьевой воды от сероводорода [Текст] / С. А. Дуров; РНИИ АКХ. - Ростов-на-Дону, 1935. - 36 с.
3. Линевич С. Н. Комплексная обработка и рациональное использование сероводородсодержащих природных и сточных вод [Текст] / С. Н. Линевич. - Москва : Стройиздат, 1987. - 88 с.
4. Плешаков В. Д. Удаление сероводорода из артезианских вод [Текст] / В. Д. Плешаков. - Москва, 1965. - 44 с.
5. Золотова Е. Ф. Очистка воды от железа, марганца, фтора и сероводорода [Текст] / Е. Ф. Золотова, Г. Ю. Асс. - Москва: Стройиздат, 1975. - 176 с.
6. Асс Г. Ю. Рекомендации по проектированию станций для очистки природной воды от сероводорода [Текст] / Г. Ю. Асс. - Москва : ВНИИВОДГЕО, 1980. - 30 с.
7. Клячко В. А. Очистка от сероводорода природных и сточных вод [Текст] / В. А. Клячко, Г. Ю. Асс, О. Д. Левентон // Водоснабжение и санитарная техника. - 1973. - № 10. - С. 29-34.
8. Фесенко Л. Н. Научное обоснование, разработка технологии очистки и дальнейшего использования вод, содержащих йод, бром, сероводород [Текст] : дис. ... д-ра техн. наук / Фесенко Л. Н. - Москва, 2004. - 377 с.
9. Николадзе Г. И. Технология очистки природных вод [Текст] : учеб. для вузов/ Г. И. Николадзе. - Москва : Высш. шк., 1987. - 479 с.: ил.
10. Бричаг О. Физико-химическая характеристика сероводородных вод и их агрессивность [Текст] / О. Бричаг // Вода и экология: проблемы и решения. - 2006. - № 3. - C. 12-16.
11. Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест: ГН 2.1.6.1338- Москва: Минздрав России, 2003. - 54 с.
12. Выбор и обоснование метода очистки высококонцентрированных сероводородосодержащих вод [Текст] / Л. Н. Фесенко [и др.] // Технологии очистки воды «Техновод-2006»: материалы III Междунар. науч.-практ. конф., посвящ. 10-летию пром. пр-ва и использования оксихлоридного коагулянта ОХА в России, г. Кисловодск, 2-5 окт. 2006 г. Юж.-Рос. гос. техн. ун-т (НПИ). - Новочеркасск: ООО НПО «Темп», 2006. - С. 60-65.
13. Петров, М. А. О выборе окислителя для очистки оборотных вод от сернистых соединений [Текст] / М. А. Петров, Е. М. Богатырева, Н. А. Верзе // Обогащение руд. - 1977. - № 2. - С. 33-34.
14. Long-term field test of an electrochemical method for sulfide removal from sewage [Text] / Ilje Pikaar [et al.] // Water research. - 2012. - № 46. - P. 3085-3093.
15. Агаев Г. А. Окислительные процессы очистки сернистых природных газов и углеводородных конденсатов [Текст] / Г. А. Агаев, В. И. Настека, З. Д. Сеидов. - Москва: Недра, 1996. - 301 с.
16. Очистка гальваностоков сульфидсодержащими сточными водами нефтехимических производств [Текст] / И. Г. Шайхиев [и др.] // ЭКИП. - 2008. - № 6. - С. 14-16.
17. Пат. 2078053 Российская Федерация, МПК6 С02F1/58. Способ очистки сернисто-щелочных сточных вод от сульфидов [Текст] / Кочинашвили М. В. [и др.]; заявитель и патентообладатель АО «Уфаоргсинтез». - № 94000994/25; заявл. 12.01.94; опубл. 27.04.97.
18 Пат. 2165892 Российская Федерация, МПК6 С02F1/46. Способ очистки сточных вод от сульфидов [Текст] / Быковский Н. А.; заявитель и патентообладатель Уфимский гос. нефт. техн. ун-т. - № 99122118/12; заявл. 20.10.99; опубл. 27.04.01.
19 Пат. 2478577 Российская Федерация, МПК С02F1/24, С02F1/54, С02F9/02, С02F9/04, B01D21/02, B03D3/02, С02F103/06. Способ очистки вод подземных источников от сероводорода и примесей и устройство для его реализации [Текст] / Му- ляк В. В. [и др.] ; патентообладатель ООО «ЛУКОЙЛ-Коми». - № 2011119281/05; заявл. 06.05.11; опубл. 10.04.13.
20. Пат. 2482066 Российская Федерация, МПК С02F1/00. Способ очистки природных и сточных вод от сероводорода, ионов сульфида и гидросульфида [Текст] / Мазитов Л. А. [и др.]; патентообладатель Мазитов Л. А., Финатов А. Н., Финатов И. Л. - № 2012106920/05; заявл. 28.02.12; опубл. 20.05.13.
21. Ласков Ю. М. Очистка сточных вод предприятий кожевенной и меховой промышленности [Текст] / Ю. М. Ласков, Т. Г. Федоровская, Г. Н. Жмаков. - Москва: Легкая и пищевая пром-сть, 1984. - 166 с.
22. Душин Б. М. Методы очистки сточных вод кожевенных заводов [Текст] / Б. М. Душин, В. И. Григорьева Л. А. Фридман. - Москва: Легкая индустрия, 1978. - 95 с.
23. Пат. 2013379 Российская Федерация, МПК5 С02F1/58. Способ очистки сточных вод от сульфидов [Текст] / Ханин А. Б., Иванов А. Д., Шель Я. И.; заявитель Курское науч.-произв. кожевенно-обувное об-ние, патентообладатель Науч.-исслед. и-т кожи. - № 4883022/26; заявл. 19.11.91; опубл. 30.05.94.
24. Заявка 2004112221 Российская Федерация, МПК7 С02F1/00. Способ очистки природных и сточных вод от сульфидов и сероводорода [Текст] / Гириков О.Г.; заявитель Новосиб. гос. архит.-строит. ун-т. - № 20044112221/15; заявл. 21.04.04; опубл. 10.10.05.
25. Пат. 2361822 Российская Федерация, МПК С02F1/74, B01D37/02, С02F103/02. Способ очистки воды от сероводорода и сульфидов [Текст] / Гириков О.Г.; патентооблада-тель ГОУ ВПО Новосибирский гос. архит.- строит. ун-т (Сибстрин). - № 2007129872/15; заявл. 03.08.07; опубл. 20.07.09.
26. Кочетков А. Ю. Катализаторы жидкофазного окисления сернистых соединений в сточных водах [Текст] / А. Ю. Кочетков, Р. П. Кочеткова, С. А. Резников. - Водоочистка. - 2007. - № 7. - С. 13-20.
27. Пат. 55-33955 Япония С 02 F 1/74, C 01 B17/06, 17/62. Способ очистки сточных вод от сероводорода [Текст]. - 03.09.1980 // Изобретения стран мира. - 1981. - № 6.
28. Пат. 2202840 Великобритания C 02 F 1/74. Удаление сероводорода из воды [Текст]. -05. 10. 1988 // Изобретения стран мира. -1980. - № 10.
29. Фесенко Л. Н. Очистка воды от сероводорода с использованием электрохимических процессов [Текст] / Л. Н. Фесенко. - Ростов-на-Дону: Изд-во СКНЦ ВШ, 2001. - 150 с.
30. Заявка 94000406 Российская Федерация, МПК6C02F1/58. Способ очистки вод от сероводорода [Текст] / Фесенко Л. Н., Федькушов Ю. И., Бабаев А. А. - № 94000406/26; заявл. 05.01.94; опубл. 27.06.95.
31. Калюжный С. В. Безреагентная биокаталитическая очистка сероводородсодержащих газов [Текст] / С. В. Калюжный, В. В. Федорович // Экология и промышленность России. - 2000. - № 2. - С. 33-36.
32. Раковская М. И. Микробиологическая характеристика активных илов, очищающих сероводородсодержащие сточные воды [Текст] / М. И. Раковская, М. Ф. Лазарева // Микробиология. - 1961. - Т. 30, вып. 3. - С. 431-417.
33. Раковская М. И. Микробиологическая характеристика биопленки, очищающих сероводородсодержащие сточные воды [Текст] / М. И. Раковская, М. Ф. Лазарева // Микробиология. - 1961. - Т. 30, вып. 4. - С. 487-491.
34. Козырев Д. П. Удаление сероводорода из артезианских вод посредством гидрата окиси железа с последующей их регенерацией [Текст] / Д. П. Козырев, И. Г. Купцов. - Москва : Гостоптехиздат, 1946. - 28 с.
35. Совершенствование технологии очистки высококонцентрированных сульфидных сточных вод [Текст] / А. Ю. Черкесов [и др.] // Водоснабжение и санитарная техника. - 2012. - № 4. - С. 67-73.
36. Черкесов А. Ю. Физико-химические и экологические аспекты технологии очистки сернисто-щелочных стоков с пиролизных установок [Текст] / Л. Н. Фесенко, А. Ю. Черкесов, С. И. Игнатенко // Нефтепереработка и нефтехимия. - 2013. - № 5. - С. 44-48.
37. Экспериментально-производственные исследования железо-каталитической технологии очистки сернисто-щелочных стоков производства мономеров [Текст] / А. Ю. Черкесов [и др.] // Яковлевские чтения, посвящ. памяти акад. РАН С. В. Яковлева, 15-16 марта 2012 г., Москва / ФГБОУ ВПО «Моск. гос. строит. ун-т». - Москва: МГСУ, 2012. - С. 152-163.
38. Технологические схемы очистки воды от сульфидов методом железо-каталитического окисления кислородом воздуха [Текст] / А. Ю. Черкесов [и др.] // Технологии очистки воды «Техновод-2014»: материалы VIII Междунар. науч.-практ. конф., г. Сочи, 23-24 окт. 2014 г. / Юж.-Рос. гос. техн. ун-т (НПИ). - Новочеркасск: Лик, 2014. - С. 118-129.
39. Черкесов А.Ю. Очистка сернисто-щелочных сточных вод нефтеоргсинтеза от сероводорода: диссертация на соискание ученой степени кандидата технических наук: 05.23.04 / Черкесов Аркадий Юльевич;[Место защиты: Волгоградский государственный архитектурно-строительный университет - ГУВПО].- Волгоград, 2015.- 173 с.
Methods of removing hydrogen sulfide from industrial wastewater and their development
Hydrogen sulfide is a toxic substance often found in wastewater of many industries in that its content is strictly regulated. The removal of hydrogen sulfide from the water-binding operation, due to its very high toxicity and aggressiveness towards steel, concrete and many other materials. Despite ongoing research, the interest is not reduced and the search continues for new solutions, eliminating the environmental pollution by hydrogen sulfide in process water treatment, economical, simple and reliable in operation.
Keywords: hydrogen sulfide, sulfides, waste water, removal of hydrogen sulfide from water, the process.
Fesenko Lev Nikolaevich, doctor of technical Sciences, South>Russian state Polytechnic University (NPI) named after M. I. Platov. 346428, Rostov region, Novocherkassk, St. Education, 132. E>mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript..
Cherkesov Arkadi Yulievich, candidate of technical Sciences, chief engineer at OOO NPP «Ekofes». 346421, Rostov region, Novocherkassk, ul, etc., 200V. E>mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript..
Ignatenko Sergey Ivanovich, candidate of technical Sciences, Deputy Director on scientific work, LLC «Ekofes». 346421, Rostov region, Novocherkassk. Ul, etc., 200V.
Журнал «Вода Magazine», №2 (102), 2016 г.
