Оценка токсичности водных сред, содержащих соли тяжелых металлов
УДК 628.356+574.64
В настоящее время оценка загрязнения водных сред производится главным образом на основе результатов физико-химического анализа. Однако из-за огромного разнообразия загрязняющих веществ и их источников, сложности и высокой стоимости химических анализов организовать эффективный экологический мониторинг средствами аналитической химии не всегда возможно. Кроме того, результирующий отклик биологической системы на воздействие экотоксикантов нельзя предвидеть исходя только из информации о результатах подобных анализов. Поэтому для оценки токсичности природных и сточных вод и иных объектов окружающей среды используют тесты на различных живых организмах.
Ключевые слова: загрязнение водных сред, соли тяжелых металлов, биотестирование.
Предоставляя незначительную информацию о природе поллютанта, биотестирование дает возможность с большой степенью достоверности определить уровень интегральной токсичности среды благодаря высокой чувствительности, надежности, универсальности метода.
Учитывая тот факт, что ни один даже самый информативный тест не может дать полной информации об изменении качества среды, необходимо использовать системы взаимоперекрывающихся тестов, которые должны включать как простые, так и высокоорганизованные системы. Поэтому при выборе комплексной тест-системы для оценки качества среды мы руководствовались следующими известными принципами [1]:
- тест-система должна включать представителей двух трофических уровней - автотрофов и гетеротрофов;
- в ее составе должны быть представлены различные царства живого - микроорганизмы, простейшие, растения, животные;
- используемые тест-объекты - организмы должны быть легко культивируемыми в лабораторных условиях, а регистрация тест-реакций не требовать использования сложной и дорогостоящей аппаратуры.
Тяжелые металлы (Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo) относятся к приоритетным загрязняющим веществам, наблюдения за которыми обязательны не только в водной, но и во всех остальных средах. Немаловажную роль при этом играют такие свойства тяжелых металлов, как высокая токсичность для живых организмов при относительно низких концентрациях, а также способность к биоаккумуляции и биомагнификации в трофических сетях экологических систем [2].
Для проведения экспериментальных исследований в работе использовали: простейших - инфузории (Stulonichia postulata), беспозвоночных животных - ветвистоусые рачки (Daphnia magna), низшие растения - ряска Lemna gibba и одноклеточные зеленые водоросли - Chlorella sp.
Модельными системами служила вода, искусственно загрязненная такими поллютантами, как тяжелые металлы (соли меди, никеля, кобальта).
Использование дафний для оценки качества водных сред в условиях наших экспериментов показало, что 50%-ая гибель рачков (ЛК50) в средах с концентрацией меди, никеля и кобальта в количестве ПДК наблюдалась через 10, 48 и 96 часов соответственно, что вполне согласуется с чувствительностью дафний к указанным металлам [3].
Преимущества использования инфузорий для тестирования заключаются в коротком цикле размножения, быстром росте численности популяции, простоте содержания и высокой чувствительности к токсичным загрязнителям среды. В аналитическом аспекте инфузории интересны тем, что могут рассматриваться как простые рецепторно-эффекторные системы, обладающие способностью реагировать на химическое воздействие целым комплексом биологических, физиологических и биохимических изменений. Подвижность инфузорий является весьма чувствительным параметром к действию как физических, так и химических факторов среды обитания. Однако в литературе ограничены и противоречивы данные о чувствительности инфузорий к конкретным экотоксикантам, а значит, и о возможности их использования для биотестирования конкретных объектов окружающей среды [4].
Степень токсичности водной среды определяли по выживаемости стилонихий через 1 час экспозиции, подсчитывая особи, которые прекращают движение и (или) подвергаются распаду (лизису), с помощью автоматизированной биотехнической системы «Биолат-2». Токсичность исследуемой воды оценивали по результатам экспериментов: 70-100% выживших особей - среда нетоксична; 40-69% выживших - среда слаботоксична; 0-39% выживших - среда токсична. Результаты исследования представлены в таблице 1.
Таблица 1. Сравнительная характеристика чувствительности инфузорий к солям тяжелых металлов
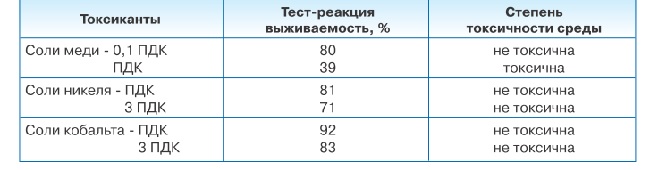
Достоверное снижение количества Stulonichia postulate наблюдается во всех случаях при указанных концентрациях токсикантов. Четко заметна более высокая чувствительность инфузорий к меди (количество выживших клеток составило 39% при ПДК металла) по сравнению с никелем и кобальтом, где величина этого показатель составила 81% и 92% соответственно. Увеличение концентрации никеля и кадмия до 3 ПДК практически не приводит к снижению количества выживаемых инфузорий (>70% выживших организмов).
Успешное применение сегодня находят дикорастущие фитотесты, в частности, из семейства рясковых. В экспериментах использовали ряску Lemna gibba, обитающую в местных водоемах.
Как известно [5], биотестирование с помощью видов семейства рясковых можно проводить на нескольких уровнях: на уровне клетки (по реакции ингибирования фототаксиса), на уровне органов (фиксация морфологических отклонений растений ряски от нормы под действием загрязнителя: хлорозы, пожелтения, увядания листьев, специфические реакции), на уровне организма и популяции (метод подсчета реализации репродуктивного потенциала, метод витального окрашивания). Исторически именно морфологические реакции организмов на техногенные факторы вошли в практику оценки качества среды. Биологическими параметрами являются изменение окраски листеца: пожелтение, побурение, потеря интенсивности окраски, обесцвечивание.
В таблице 2 представлены результаты проведенных экспериментов с использованием ряски малой.
Таблица 2. Характеристика чувствительности ряски к соединениям тяжелых металлов

Как следует из данных таблицы, среди тяжелых металлов наиболее токсичной по отношению к ряске Lemna gibba оказалась соль меди: к третьим суткам при 0,1 ПДК меди в воде наблюдалось побурение листецов, при концентрации ПДК проявлялось частичное обесцвечивание, сопровождающееся их расслоением (до 40% листецов одиночны), которое при 3ПДК достигло75% от суммарного количества листецов. При изучении влияния солей никеля на ряску первая реакция (незначительное побурение поверхности) появилась только через 4 суток от начала эксперимента. Расслоение листецов, составившее 60%, и обесцвечивание корней были характерны для ряски в среде с десятикратным превышением ПДК никеля.
Отмеченное ингибирующее действие (потеря окраски, обесцвечивание листецов и корней, расслоение листецов) меди и никеля определяется, видимо, способностью данных металлов нарушать структуру мембран, образуя комплексы с белками и фосфолипидами, что приводит к нарушению целостности организма (имеет место лизис листецов) и доступности воздействия на него токсичного металла. В отличие от ионов никеля и меди в присутствии кобальта, как видно из представленных результатов, наблюдалось лишь побурение поверхности отдельных листецов при концентрации 10 ПДК и незначительное расслоение листецов (10%).
Испытуемые одноклетчные зеленые водоросли Chlorella sp оказались устойчивы к солям тяжелых металлов даже при концентрации последних выше 10 ПДК, за исключением солей меди, при концентрации которых более 10 ПДК через две недели от начала эксперимента в той или иной степени проявлялось ингибирующее воздействие (биостатический эф- фект) вплоть до полного подавления роста микроорганизмов в жидкой среде.
В отличие от зеленых одноклеточных нитчатые сине-зеленые водоросли проявляли большую чувствительность к исследуемым токсикантам [6]. Полученные данные свидетельствуют о том, что уже в концентрациях 10 ПДК и более соли кобальта, меди и никеля вызывают гибель значительной части водорослей.
Ряска как тест-объект реагировала изменением окраски не только на группы тяжелых металлов, но и на каждый исследуемый металл по-разному, изменяя окраску в присутствии меди в концентрации 0,1 ПДК через 3 часа, через 4 часа - при концентрации никеля в 3 ПДК, через 6 часов - при концентрации кобальта 10 ПДК. Инфузории, при использовании которых время проведения острого эксперимента составляет 1 час., оказались менее чувствительны к металлам (за исключением меди) даже при концентрации 3 ПДК. В условиях присутствия последнего наблюдалась согласованная реакция инфузорий и ряски, зафиксированная в случае с ряской через двое суток.
Таким образом, в процессе поиска быстрых и адекватных тестов, с помощью которых можно было бы выявлять присутствие токсичных веществ в почве и водных средах, мы получили своеобразную комплексную тест-систему. Предпочтение в этой системе при анализе сред, содержащих тяжелые металлы, можно отдать традиционному биотестированию с использованием ветвистоусых рачков рода Daphnia magna, реагирующих на концентрации всех исследуемых металлов - меди, никеля и кобальта - в пределах ПДК. Однако проведение исследования в этом случае потребует соблюдения временного регламента (не менее 10 часов).
При загрязнении вод солями меди до концентрации ПДК и более вполне оправдано будет использование «острого» (кратковременного) (длительность - 1 час) теста с инфузориями, численность которых резко снижается в интервале указанных концентраций или более длительного (3 суток) с ряской, которая отреагирует побурением окраски по периферии отдельных листецов.
Достоверность полученных результатов по выявлению токсичности водных сред методами биотестирования возрастает с расширением используемых методов и тест-объектов.
Работа подготовлена в рамках выполнения проектной части государственного задания по Заданию № 14.2406.2014/К. и реализации программы стратегического развития БГТУ им. В.Г. Шухова на 2012-2016 гг.
Литература:
1. Мелехова О.П. Биологический контроль окружающей среды: биоиндикация и биотестированне: учеб, пособие для студ. высш. учеб. заведений / О. П. Мелехова, Е. И. Егорова, Т. И. Евсеева и др.; под ред. О. П. Мелеховой и Е. И. Егоровой. - М.: Издательский центр «Академия», 2007. - 288 с.
2. Perales-Vela HV, Pena-Castro JM, Canizares-Villanueva RO (2006) Heavy metal detoxification in eukaryotic microalgae. Chemosphere 64: 1-10.
3. Щеткина Т.Н. Использование автоматизированной биотехнической системы и простейших одноклеточных организмов для биотестирования объектов окружающей среды, автореферат диссертации на соискание ученой степени кандидата биологических наук, Калуга, 2007 г.
4. Виноходов Д.О. Научные основы биотестирования с использованием инфузорий автореферат диссертации на соискание ученой степени доктора биологических наук, Санкт-Петербург, 2007.
5. Цаценко Л. В., Малюга Н. Г. Рясковые - биоиндикаторы агроценоза: Монография / КубГАУ, Краснодар, 2000. – 76 с.
6. Гончарова Е.Н., Василенко М.И., Нарцев В.М. Роль микроскопических водорослей в процессах повреждения зданий. // Вестник Белгородского государственного технологического университета им. В.Г. Шухова. 2014. №6. с.192-196.
Evaluation of the toxicity of aqueous media containing salts of heavy metals
Currently, the assessment of pollution of aquatic environments is mainly based on the results of physico-chemical analysis. However, due to the great diversity of pollutants and their sources, the complexity and high cost of chemical analyses to organize an effective environmental monitoring tools-you and analytical chemistry may not always be possible. In addition, the output response of biological systems to the effects of toxicants cannot be predicted solely on the basis of information on the results of these tests. Therefore, to evaluate toxic activities of natural and waste waters and other environmental objects used by TEC-you different living organisms.
Key words: pollution of water environments, salt, heavy metalov, bioactivation.
Vasilenko Marina Ivanovna, PhD (Biology), associate Professor of Department of industrial ecology;
Goncharova Elena Nikolaevna, PhD (Biology), associate Professor of Department of industrial ecology.
Belgorod state technological University named after V. G. Shukhov. Russia, 308012, Belgorod, Kostyukova str., 46, BGTU im. V. G. Shukhov. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Журнал «Вода Magazine», №11 (111), 2016 г.














