Оценка эффективности обеззараживания воды с позиции уменьшения в ней токсичных продуктов окисления
При обеззараживании воды необходимо решать три основные задачи: обеспечивать эффективное обеззараживание воды на стадии ее обработки, сохранять требуемое качество питьевой воды при подаче ее потребителю и не допускать образования повышенных концентраций токсичных побочных продуктов окисления в питьевой воде. Каждый из основных методов обеззараживания воды имеет свои плюсы и минусы. С учетом этого разработаны варианты применения различных методов, обеспечивающие необходимую степень обеззараживания и качество питьевой воды, соответствующее современным требованиям.
Повышение санитарной надежности систем водоснабжения и обеспечение населения качественной и безопасной для здоровья питьевой водой является одной из наиболее важных и сложных задач водоснабжения. Основным приемом обработки воды, обеспечивающим ее надежное обеззараживание, а также позволяющим поддерживать санитарное состояние очистных сооружений, является хлорирование. Однако известно, что при обработке хлорреагентами (газообразным хлором и гипохлоритом натрия) воды, содержащей органические вещества природного и антропогенного происхождения, образуются токсичные галогенорганические соединения (ГОС), часть из которых обладают выраженной мутагенной и канцерогенной активностью и способствуют возникновению онкологических заболеваний.
Всего в питьевой воде идентифицировано более 500 различных ГОС. К наиболее представительным группам относятся летучие галогенорганические (ЛГС) соединения, такие как тригалогенметаны, хлорфенолы, галогенпроизводные уксусной кислоты (моно-, дихлорацетиловая кислоты, дибромацетиловая кислота), галокетоны (ди-, трихлорпропанон), альдегиды, галоацетонитрилы (ди-, трихлорацетонитрил, бромхлорацетонитрил), хлоралгидрат, хлоропикрин и др.
Во всем мире уделяется большое внимание присутствию ЛГС в питьевой воде и во многих странах приняты соответствующие документы, нормирующие содержание в ней галогенорганических соединений, причем в ряде стран на весьма низком уровне /1/.
В России предельно допустимые концентрации (ПДК) ЛГС, наиболее часто присутствующие в питьевой воде, ограничивались до 2003 года требованиями СанПиН. После подтверждения канцерогенной активности некоторых ЛГС были разработаны новые ПДК их содержания в питьевой воде, которые максимально соответствуют рекомендациям ВОЗ и ЕС. Для всех канцерогенных веществ установлен санитарно-токсикологический признак вредности и первый класс опасности (таблица 1).
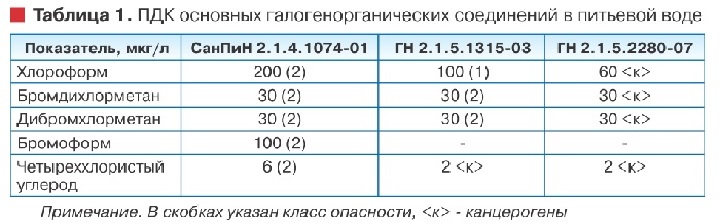
При изучении проблемы образования побочных хлорорганических соединений в питьевой воде специалисты НИИ КВОВ провели обследование более 50 водопроводных станций, установили уровни загрязнения питьевых вод побочными продуктами хлорирования, определили условия их образования и выявили факторы, влияющие на концентрацию ЛГС в питьевой воде.
Так, было установлено, что в природной воде летучие органические соединения в основном представлены алифатическими углеводородами С6 - С12 различного строения с большим числом изомеров и ароматическими углеводородами, из которых чаще всего определяется бензол, толуол, о-, м- и п-ксилолы. Присутствие летучих галогенорганических соединений в исходной воде отмечается нечасто и в незначительных концентрациях (0,2-16,3 мкг/л). В отдельных случаях, чаще в подземных водоисточниках, расположенных в промышленных районах, концентрация ЛГС достигает значительных величин - 100 мкг/л и более, что связано с загрязнением воды сточными промышленными водами.
Несмотря на существенное отличие физико-химических свойств природных вод, образование основных концентраций ЛГС отмечается после первичного хлорирования воды, которое осуществляется практически на всех водопроводных станциях, независимо от последующей технологии обработки. При этом качественный и количественный состав идентифицированных в хлорированной воде ЛГС может существенно отличаться. Однако такие соединения как хлороформ, дихлорбромметан, дибромхлорметан, бромметан, относящиеся к группе тригалогенметанов, и четыреххлористый углерод были зарегистрированы в хлорированной воде на всех обследованных водопроводных станциях.
При этом, как правило, концентрация хлороформа на 1-2 порядка превышает концентрацию других ЛГС. При наличии в водоисточнике бромидов концентрация бромсодержащих ЛГС возрастает в несколько раз. Количество образовавшихся ЛГС не изменяется по этапам очистки, что свидетельствует об отсутствии барьерной роли традиционных сооружений водоподготовки; в большинстве случаев концентрация их увеличивается при вторичном хлорировании и достигает максимальных значений в резервуаре чистой воды.
Процесс образования ЛГС отличается сложностью и зависит от качества исходной воды (вида и концентрации органических веществ, рН, солесодержания, температуры, наличия некоторых неорганических веществ), дозы хлорреагента, продолжительности контакта воды с хлорреагентом и пр. На концентрацию образующихся ЛГС влияет, прежде всего, наличие гумусовых веществ, обуславливающих цветность воды [2, 3], и нефтепродуктов. Кроме того, их концентрация существенно зависит от содержания в исходной воде планктона.
К органическим веществам, ответственным за образование ЛГС при хлорировании воды, относятся ароматические и алифатические оксосоединения, имеющие одну или несколько карбонильных групп, находящихся в орто- или пара положении, а также соединения, содержащие фенольные гидроксильные группы, способные к мезомерному эффекту с образованием карбонильных соединений.
Суммарная концентрация ЛГС в питьевой воде на различных водопроводных станциях изменяется от 10 до 500 мкг/л, а концентрация хлороформа - основного загрязняющего компонента - от 2 до 200 мкг/л в зависимости от качества исходной воды. Хлороформ присутствует в очищенной воде в 100% случаев, дихлорбромметан был обнаружен в 97,5% случаев. Основная концентрация ЛГС приходится на хлороформ, однако в отдельных случаях содержание бромзамещенных ЛГС достигает 2-3 ПДК.
Следует отметить, что уровни концентраций ЛГС, образовавшихся при хлорировании воды поверхностных водоисточников, значительно превышают концентрации ЛГС, обнаруженные при хлорировании подземных источников.
Качество воды поверхностных источников водоснабжения меняется в течение года, соответственно изменяются и условия ее обработки, дозы реагентов. На рис.1 показано изменение дозы хлора, применяемой для обеззараживания воды, и концентрации хлороформа в питьевой воде на одной водопроводной станции в различные периоды года.

Максимальные концентрации хлороформа отмечаются в летний период при увеличении хлорпоглощаемости воды, минимальные - в зимний. Такая зависимость характерна при очистке воды большинства водоисточников.
В настоящее время при очистке и обеззараживании воды поверхностных водоисточников для водоснабжения городов России применяются хлорреагенты. И пока нет альтернативы их полной замены другими методами, которые могут не только обеспечить эффективное обеззараживание воды, но и сохранить качество питьевой воды в водопроводных сетях при ее транспортировании потребителю. Хлорреагенты не только могут образовывать побочные продукты окисления, но и сами содержать различные примеси, приводящие к загрязнению питьевой воды. Установлено, что газообразный хлор вносит наименьшее количество примесей.
Гипохлорит натрия может содержать повышенные концентрации хлоратов и броматов. Диоксид хлора может быть хорошей альтернативой хлору, но генератор диоксида хлора необходимо адаптировать для конкретной установки с целью минимизации количества образующихся хлороксид+ных соединений (хлорит- и хлоратионов). Поэтому проблема присутствия побочных продуктов обеззараживания в питьевой воде в России стоит достаточно остро.
Изучение проблемы образования ЛГС при хлорировании воды позволило разработать ряд технологических приемов по очистке и обеззараживанию воды, которые могут быть использованы как в условиях действующих водопроводных станций, так и при проектировании новых сооружений. Эти рекомендации изложены в «Руководстве на технологию подготовки питьевой воды, обеспечивающую выполнение гигиенических требований в отношении хлорорганических соединений» [4].
Существует два возможных направления уменьшения концентрации ЛГС в питьевой воде: предотвращение их образования при водоподготовке и удаление на заключительных этапах обработки воды. Известные методы удаления - сорбция на фильтрах с гранулированным активным углем или синтетическими смолами и аэрация - уменьшают концентрацию ЛГС в очищенной воде на 90%. Однако высокая эффективность очистки воды этими методами достигается при значительных капитальных и эксплуатационных затратах, что может быть оправдано лишь в случае загрязнения источников водоснабжения ЛГС в концентрациях, превышающих ПДК. При отсутствии ЛГС в исходной воде целесообразно применять методы, предотвращающие их образование в процессе очистки воды.
В настоящее время на действующих водопроводных станциях предварительное хлорирование часто осуществляется высокими дозами хлора и проводится не только для обеззараживания воды и поддержания необходимого санитарного состояния водоочистных сооружений, но и с целью борьбы с планктоном, снижения цветности воды, интенсификации процессов коагуляции и т.п. При этом хлор вводится иногда в отдаленных от сооружений точках (водозаборы, ковши, каналы и т.д.). На некоторых водопроводных станциях весь хлор вводят только на этапе предварительного хлорирования, доза хлора при этом достигает 10-15 мг/л. Такие режимы хлорирования создают наиболее благоприятные условия для образования ЛГС вследствие длительного времени контакта присутствующих в воде органических загрязнений с высокими концентрациями хлора.
Поэтому в ряде случаев для уменьшения концентрации ЛГС на водопроводной станции достаточно изменить режим предварительного хлорирования воды. Как показали исследования, разовая доза хлора при обработке неочищенной воды поверхностного водоисточника не должна превышать 2 мг/л. При высокой хлорпоглощаемости воды необходимо проводить дробное хлорирование, при этом расчетная доза хлора вводится не сразу, а небольшими порциями (частично перед сооружениями первой ступени очистки воды, частично перед фильтрами).
С целью сокращения времени контакта неочищенной воды с хлором предварительное обеззараживание воды следует проводить непосредственно на очистных сооружениях. Изменение режима хлорирования воды позволяет уменьшить концентрацию ЛГС в питьевой воде на 15-30%.
Исключение предварительного хлорирования и очистка воды от органических веществ позволяет в процессе коагулирования, отстаивания и фильтрования удалить из воды до 70-90% органических соединений. Соответственно на столько же уменьшается количество образующихся при последующем хлорировании ЛГС.
В тех случаях, когда отказаться от предварительного хлорирования воды нельзя (источник водоснабжения характеризуется высоким содержанием бактериальных загрязнений или хлор используется как окислитель для удаления органических загрязнений антропогенного происхождения), хлор целесообразно заменить другими окислителями, например, озоном или перманганатом калия. Кроме того, для обеззараживания воды можно использовать диоксид хлора и связанный хлор в виде хлораминов.
Бактерицидная эффективность, представленная в виде показателя СТ, - остаточная концентрация обеззараживающего вещества С (мг/л), умноженная на необходимое для обеззараживания время контакта Т(мин), для различных хлорреагентов [5] показана в таблице 2.
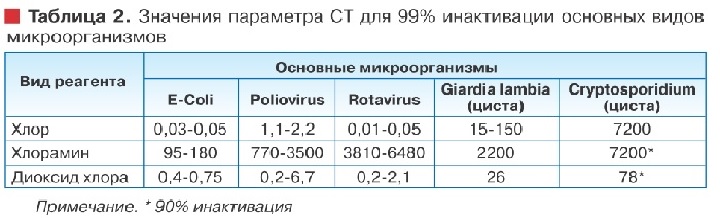
Как видно из представленных данных, наиболее эффективными в отношении рассматриваемых микроорганизмов являются хлор и диоксид хлора, хлорамины значительно им уступают, особенно при удалении Poliovirus, Rotavirus и Giardia lambia.
Поэтому при выборе вида обеззараживающего реагента необходимо учитывать качество исходной воды, т.е. наличие в ней тех или иных видов микроорганизмов.
Применение диоксида хлора для обеззараживания воды, как альтернативы хлору, позволяет уменьшить возможность образования ЛГС [6]. Бактерицидность диоксида хлора более высокая, чем хлора, на его дезинфицирующую способность не оказывает влияния рН среды и наличие аммонийного азота. Диоксид хлора при взаимодействии с органическими веществами не приводит к образованию значительного количества галогенорганических соединений.
Основными органическими полупродуктами являются альдегиды, кетоны, хиноны и низкомолекулярные карбоновые кислоты.
Ароматические соединения легко окисляются диоксидом хлора до соответствующих кетонов и спиртов. Однако использование для обеззараживания питьевой воды диоксида хлора ограничивается при обработке воды, содержащей органические вещества, так как при их окислении диоксидом хлора образуются окислы хлора (хлорит- и хлорат-ионы), которые, также как и ЛГС, обладают токсичными свойствами. Особенно токсичен хлорит-ион, ПДК которого, например, в Германии ограничено 0,3 мг/л, в Норвегии требуется полное его отсутствие в питьевой воде [7,8].
Концентрация образующихся хлорит- и хлорат-ионов зависит от количества и состава растворенных органических соединений, присутствующих в водоисточнике, а также от дозы и остаточной концентрации диоксида хлора в обрабатываемой воде.
В Германии разработана стратегия уменьшения образования побочных продуктов при использовании диоксида хлора на основе концепции «Минимальная доза диоксида хлора» (МДДХ). Основа этой концепции состоит из двух главных составляющих [9]:
- уменьшение концентрации органических веществ до обработки воды диоксидом хлора, т.е. применение его для обеззараживания очищенной воды;
- оптимальная доза обеззараживающего реагента не должна превышать 0,5 мг/л и быть такой, при которой остаточная его концентрация после 0,5 час контакта составляла бы 0,05 мг/л.
В европейских странах максимальная доза диоксида хлора ограничивается 0,4 мг/л, в США - 0,8 мг/л.
На рис. 2 показано влияние содержания органических веществ (по показателю общий органический углерод - ООУ) на минимально необходимую дозу диоксида хлора и на концентрацию образующегося хлорит-иона.
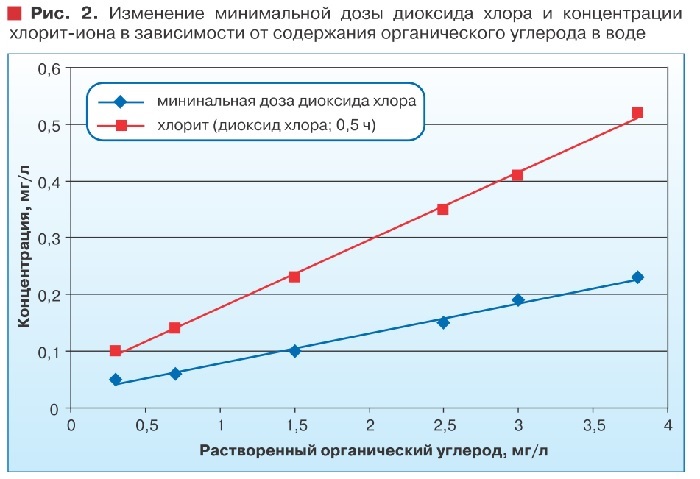
Получается, что чем меньше содержания ООУ в обрабатываемой воде, тем меньше необходимая для ее обеззараживания доза диоксида хлора и тем меньше концентрация образующегося хлорит-иона.
Использование диоксида хлора совместно с другими окислителями наиболее рационально. Это позволяет оптимизировать результаты водоподготовки и затраты на них. Хорошие результаты по эффективности обеззараживания и уменьшению концентрации ЛГС в питьевой воде были получены при совместном использовании озона и диоксида хлора. Озоном обрабатывали воду на стадии предварительного окисления воды, в результате частично удалялись органические вещества + предшественники ЛГС. Диоксид хлора вводили в воду на заключительном этапе очистки [10].
При использовании для обеззараживания воды связанного в хлорамины хлора можно существенно уменьшить концентрацию ЛГС в питьевойводе. Этот метод не требует дополнительных капиталовложений и существенных эксплуатационных затрат.
Связанный хлор обладает необходимой степенью бактерицидности и широко применяется для обеззараживания воды, но он менее реакционно способен, чем свободный хлор, дольше сохраняется в воде и не вступает во взаимодействие с органическими загрязняющими веществами, ответственными за образование ЛГС. Хлорамины образуются при хлорировании воды, содержащей аммонийный азот.
В случае отсутствия аммонийного азота в исходной воде необходимо проводить ее предварительную аммонизацию. Максимальный эффект достигается при определенном соотношении аммиака и хлора при условии, что весь хлор находится в воде в виде хлораминов, а свободный хлор отсутствует. В идеальных условиях это соотношение составляет 1:4. Для природных вод необходимое соотношение аммиака и хлора зависит от качества исходной воды и устанавливается экспериментально в каждом конкретном случае. Использование для обеззараживания воды связанного хлора применяется на многих водопроводных станциях, при этом концентрация ЛГС в питьевой воде уменьшается в 8-10 раз /11/.
В таблице 3 представлены варианты обеззараживания воды свободным и связанным хлором на двух объектах.
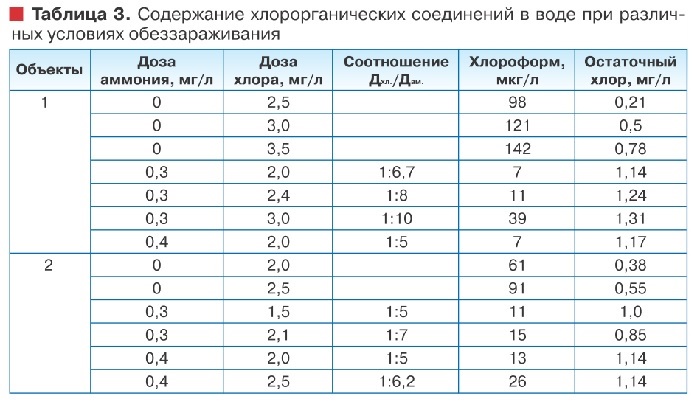
При обеззараживании воды свободным хлором без добавления аммонийного азота и при содержании остаточного свободного хлора в питьевой воде на уровне 0,5 мг/л (согласно требованиям СанПиН) концентрация хлороформа в хлорированной воде достигает 91-121 мкг/л. С предварительной аммонизацией и при оптимальном отношении доз аммонийного азота и хлора концентрация ЛГС составляет 7-13 мкг/л (остаточная концентрация связанного хлора не более 1,2 мг/л).
Применение озона на стадии предварительной обработки воды вместо хлора позволяет на 70-80% уменьшить концентрацию образующихся ЛГС. Озон является более эффективным дезинфицирующим реагентом, чем хлор, в отношении спор и вирусов. Образующиеся побочные продукты окисления органических веществ озоном представляют собой альдегиды, кетоны и карбоновые кислоты. Большинство соединений - побочных продуктов озонирования не представляют угрозы здоровью человека при тех концентрациях, которые могут быть в озонированной воде. В то же время в качестве основных продуктов реакции озона с органическими веществами, прежде всего, определяются такие соединения, как формальдегид и ацетальдегид [12], концентрация которых нормируется в питьевой воде на уровне 0,05 и 0,25 мг/л соответственно. Количество образующегося формальдегида существенно зависит от дозы озона.
Исследованиями на воде различных водоисточников установлено, что при невысоких дозах озона, которые рекомендуются при предварительной обработке воды (1-3 мг/л), концентрация формальдегида, как правило, не превышает ПДК /13/. Кроме того, побочные продукты озонирования в несколько раз менее токсичны, чем продукты хлорирования [14, 15].
В случае применения озона следует учитывать, что он неустойчив и быстро разлагается в воде, поэтому для пролонгирования обеззараживающего действия реагентов в очищенной воде вместе с озоном применяются хлорреагенты. При совместном использовании озона и хлора озонирование должно предшествовать хлорированию. Озон подвергает деструкции органические загрязнения, уменьшает их способность к взаимодействию с хлором, предотвращает образование побочных продуктов хлорирования. Уменьшается доза хлора, необходимая для обеззараживания воды.
Метод обеззараживания питьевой воды с применением ультрафиолетового излучения (УФИ) известен уже с начала прошлого века. Однако впоследствии он был вытеснен хлорированием как более дешевым методом. Ультрафиолетовое излучение является одним из современных средств обеззараживания питьевой воды. Механизм его бактерицидного действия основан на поглощении фотонов пиримидиновыми основаниями, входящими в состав ДНК. Доказана эффективность УФИ в отношении удаления различных микроорганизмов: бактерий, в том числе и в форме спор; ротавирусов и полиовирусов; цист простейших, например цист Criptosporidium.
В настоящее время УФ-установки по обеззараживанию воды широко используются в ФРГ, Дании, Норвегии, Великобритании, Швейцарии, Австрии, России и других странах.
Ультрафиолетовое излучение в необходимых для дезинфекции дозах не вызывает никаких изменений веществ, содержащихся в воде. При УФИ не образуются никакие побочные продукты, посторонние запахи и не меняется вкус воды. Метод УФИ не требует реакционной емкости и отличается надежностью и простотой управления и эксплуатации. Время контакта с обрабатываемой водой при использовании ультрафиолетового излучения для обеззараживания короткое (секунды) и определяется в основном интенсивностью излучения и физическими характеристиками воды. Станции УФИ для обеззараживания воды компактны, не занимают больших площадей. В отношении техники безопасности эти станции надежны. Эффективность УФИ воды не зависит от рН и температуры воды.
Однако ультрафиолетовое излучение малоэффективно при обработке мутных вод. Кроме того, на заключительном этапе обеззараживания воды УФИ не может быть применено из-за отсутствия пролонгирующего действия в водопроводных сетях. Поэтому при подаче воды потребителю в очищенной воде должен присут ствовать хлорреагеагент. Особенно это необходимо для сохранения качества воды при распределении ее в протяженных, разветвленных водопроводных сетях в крупных населенных пунктах и городах, а также при транспортировании воды на большие расстояния.
В таблице 4 показаны основные преимущества и недостатки рассмотренных методов обеззараживания воды.
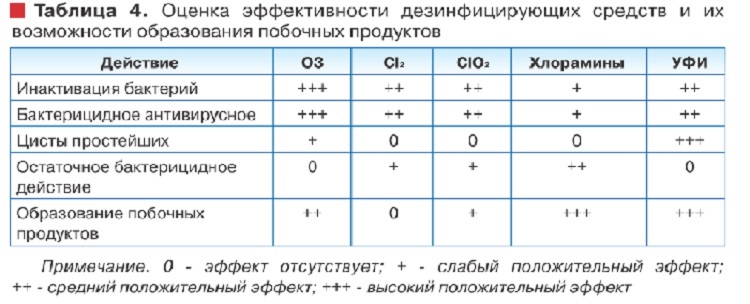
Из представленных в таблице дезинфицирующих средств ультрафиолетовое излучение является одним из наиболее эффективных методов обеззараживания воды против всех микроорганизмов, включая цисты простейших, при использовании которого не образуются побочные продукты.
Из-за отсутствия остаточного обеззараживающего действия применение УФИ должно сочетаться с введением другого дезинфицирующего реагента, например, хлора, или хлорамина. Кроме того, ультрафиолетовое излучение следует применять для обеззараживания осветленной воды, в противном случае эффективность его существенно уменьшается.
С целью предотвращения образования ЛГС и пролонгирования действия обеззараживающего реагента в воде наиболее целесообразно применять УФИ в сочетании с хлораминами.
Анализом работы станций различной производительности, использующих УФИ для обеззараживания воды, установлено, что эта система характеризуется простотой управления, относительно низкими капитальными и эксплуатационными расходами, компактностью и безопасностью. Основными эксплуатационными расходами являются замена ламп и потребляемая электроэнергия.
В таблице 5 представлены различные сочетания основных методов обеззараживания воды, рекомендуемых как альтернативные хлору, для уменьшения образования ЛГС и обеспечения высокой эффективности обеззараживания питьевой воды.
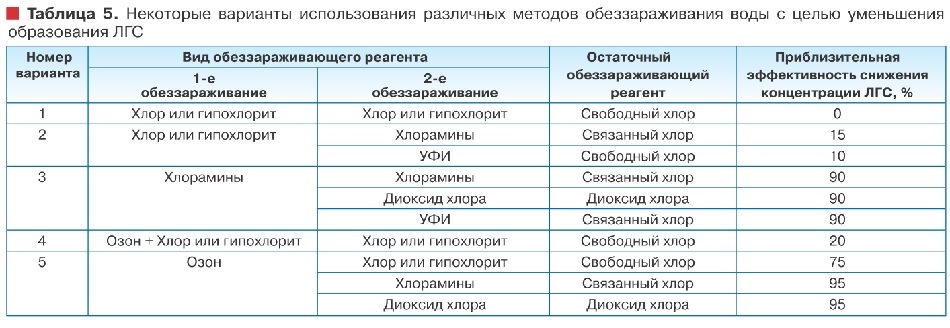
Выбор и применение тех или иных методов обеззараживания воды необходимо проводить с учетом качества воды водоисточника, технологии ее обработки и на основании результатов предварительных технологических изысканий.
Выводы:
1. При использовании для обеззараживания воды газообразного хлора и гипохлорита натрия (химического или электролизного) в питьевой воде образуются токсичные галогенорганические соединения в концентрациях, превышающих ПДК.
2. При обеззараживании воды необходимо решать три основные задачи: обеспечивать эффективное обеззараживание воды на стадии ее обработки; сохранять требуемое качество питьевой воды при подаче ее потребителю; не допускать образования повышенных концентраций токсичных побочных продуктов окисления в питьевой воде.
3. Предложены варианты применения различных обеззараживающих методов, обеспечивающие необходимую степень обеззараживания воды ипозволяющие существенно уменьшить концентрацию ЛГС в питьевой воде.
Литература:
1. An assessment of the presence of trihalomethanes in water intended for human consumption fnd the practical means to reduce their concentration without compromising disinfection efficiency. Administrative arrangement: B4-3040/95/000436/MAR/DI, June 1996.
2. Гюнтер Л.И., Алексеева Л.П., Хромченко Я.Л. Влияние условий хлорирования воды на образование хлороформа. Химия и технология воды, 1985, 1985, 7, № 6.
3. Гюнтер Л.И., Алексеева Л.П., Хромченко Я.Л. Влияние органических примесей в природной воде на образование токсичных галогеналканов при ее хлорировании. Химия и технология воды, 1986, 8, № 1.
4. Руководство на технологию подготовки питьевой воды, обеспечивающую выполнение гигиенических требований в отношении хлорорганических соединений. Москва, 1989,ОНТИ НИИ КВОВ.
5. Degremont. Технический справочник по обработке воды. Санкт-Петербург, 2007.
6. Impact de differents traitements d'eau potable sur la consommatipn en bioxyde dechlore et sur la formation de sous-produits d'oxydation . Morissette C., Prevost M., Langlais B. Aqua, 1996, 45, № 5.
7. Brett R.W., Ridgeway J.W. Experiences with chlorine dioxide in southern water authority and water research centre. J.Inst.Water Eng. and Sci., 1981, 35, N2.
8. Greenberg A.E. Public health aspects of alternative water disinfectants. J.AWWA, 1981, 73, N 1.
9. Bohme U., Brauch H.J. The impact of natural organic matter on the formation of inorganic disinfection by-products. Disinfection by-products: The way forward. Cambridg, 1998.
10. Masschlein W.G. The state of art in use of chlorine dioxide and ozon in the treatment of water. Water S.A., 1980, 6, N 3.
11. Алексеева Л.П. Снижение концентрации хлорорганических соединений, образующихся в процессе подготовки питьевой воды. Водоснабжение и санитарная техника. 2009. № 9.
12. Singer P.C. Assessing ozonation research needs in water treatment. J.AWWA, 1990, vol.82, № 10.
13. Апельцина Е.И., Алексеева Л.П., Черская Н.О. Проблемы озонирования при подготовке питьевой воды. Водоснабжение и санитарная техника. 1992. № 4.
14. Алексеев С.Е. Исследование токсичности воды, прошедшей очистку с использованием окислителей. Экологическая конференция Охрана окружающей среды на пороге 3-го тысячелетия в интересах устойчивого развития», Москва, 1999.
15. Климкина Н.В., Цыплакова Г.В.,Трухина Г.М., Драгинский В.Л. Гигиеническая оценка обесцвечивания природных вод окислительно-сорбционным методом. Гигиена и санитария. 1987, № 1.
Журнал «Вода Magazine», №9 (85) 2014 г.














