УДК 579.6+001.891.53+658.562
Ключевые слова: общие колиформные бактерии, производственный контроль, экспресс-методы.
На сегодняшний день бактериологический метод остается «золотым стандартом» санитарной микробиологии, дающим наиболее достоверную оценку санитарного состояния исследуемых объектов. Тем не менее, бактериологический метод обладает рядом недостатков. Прежде всего, это длительность исследования. Рутинный бактериологический анализ по определению общих колиформных бактерий (ОКБ), термотолерантных колиформных бактерий (ТКБ) и E.coli занимает, по меньшей мере, 48-72 часа. Особенно значим этот аспект для контроля качества водоподготовки, при котором традиционные методы бактериологического контроля имеют фактически ретроспективный характер. Не последнее место занимает и трудозатратность метода, связанная с обеспечением выполнения анализа и, не в последнюю очередь, с приготовлением, стерилизацией, разливкой и хранением готовых питательных сред.
Для ускорения процедуры анализа в состав современных питательных сред помимо селективных добавок, подавляющих рост нецелевой микрофлоры, вносятся специальные добавки, позволяющие определять маркеры, высокоспецифичные для той или иной группы целевых микроорганизмов. Использование таких добавок позволяет облегчить учет и сократить время анализа за счет сокращения этапа идентификации.
Для определения колиформных бактерий в качестве специфического маркера чаще всего используют фермент бета-галактозидазу, характерную для этой группы микроорганизмов. Для идентификации E.coli используют фермент бета-глюкуронидазу, высокоспецифичную для кишечной палочки. Комбинированные среды содержат оба маркера для одновременного определения E.coli и ОКБ. Ферменты расщепляют соответствующие субстраты, что приводит к образованию цветных комплексов, окрашивающих колонии в характерный легко идентифицируемый цвет. Однако, если бета-глюкуронидаза высокоспецифична и ее выявление в комбинации с положительным тестом на индол позволяет с вероятностью, превышающей 95%, утверждать о принадлежности штамма к E.coli, то с идентификацией ОКБ и ТКБ все не так просто [2]. Бета-галактозидазной активностью помимо колиформных бактерий обладают такие широко распространенные свободноживущие оксидазоположительные микроорганизмы, как аэромонады. Этот факт делает затруднительным применение хромогенных сред, использующих в качестве маркера бета-галактозидазу, для определения колиформных бактерий в окружающей среде, и прежде всего в воде [3].
Еще одним перспективным решением, упрощающим процедуру бактериологического анализа, является использование питательных сред на специальных подложках. Срок хранения таких сред не уступает сухим, а способ применения заметно проще, так как исключаются этапы приготовления, стерилизации и разливки, нет необходимости в подготовке посуды, а инокуляция пробы, в большинстве случаев, не требует сложных манипуляций. На рынке питательных сред представлен широкий ассортимент подобной продукции. Из наиболее известных тест-систем можно назвать подложки RIDA® COUNT [5], CompactDry® [4], Petrifilm® [1].
Нас заинтересовала продукция американской компании 3М, которая выпускается под торговой маркой Petrifilm®. В ее основе лежит использование хромогенных добавок и метоксил пектина - агента, способного образовывать плотный гель при комнатной температуре [2]. Подготовленный образец в объеме 1 мл наносится на поверхность сухой среды, расположенной на специальной пластиковой подложке, накрывается сверху прозрачной пленкой и специальным распределителем (spreader) распределяется по всей поверхности среды. В течение короткого времени образуется гелеобразная среда, плотно прилегающая к поверхности покровной пленки. Данный аспект исполнения немаловажен, так как сообщает рассматриваемой системе уникальную способность, выделяющую Petrifilm® из перечня подобных тест-систем. В отличие от других, подложки Petrifilm® позволяют учитывать газообразование, возникающее при утилизации лактозы в процессе первичной инкубации в течение 24-48 часов. Эта особенность является значимой в первую очередь для отечественных лабораторий, поскольку образование газа при сбраживании лактозы в нашей нормативной базе является обязательным признаком при идентификации общих и термотолерантных колиформных бактерий (ОКБ и ТКБ). Именно возможность определения газообразования из лактозы в первые сутки и привлекла наше внимание к данным тест-системам.
Фирма-производитель Petrifilm® позиционирует их в первую очередь как средство микробиологического контроля пищевых продуктов, лекарственных средств и косметики. В данной работе мы попытались оценить возможность использования Petrifilm® для определения показателей ОКБ и E.coli в воде, оценить их ростовые и дифференцирующие свойства в сравнении с традиционными средами и методами исследования.
Материалы и методы
Работа выполнялась в несколько этапов. На первом этапе мы оценивали принципиальную возможность применения трех видов Petrifilm®: Petrifilm® CC, Petrifilm® HSCC и Petrifilm® EC для санитарного контроля воды. В работе было исследовано по одной серии каждого типа тест- систем. Использование тест-систем проводили согласно инструкциям производителя.
На втором этапе была проведена оценка ростовых и дифференцирующих свойств Petrifilm® указанных выше модификаций. Определение ростовых и дифференцирующих свойств проводилось в трех вариантах: с использованием суспензий эталонных штаммов E.coli, с использованием природной воды и с использованием проб природной воды, обогащенных суспензией эталонных штаммов E.coli.
Оценка ростовых параметров Petrifilm® на суспензиях чистых культур E.coli была выполнена путем определения показателя % всхожести по методике, представленной в [6]. В качестве контрольных сред были использованы питательный агар (ПА) производства HiMedia серии 0000053484 и среда Эндо производства НПО «Питательные среды» (г. Махачкала), 28 серии с добавками согласно [8]. Исследование проводили с использованием двух штаммов E.coli М17-02 и E.coli АТСС25922 из рабочей коллекции эталонных культур ЗАО «РОСА». Посев на контрольную среду выполняли методом мембранной фильтрации. Для посева на Petrifilm® СС и HSCC посевная доза предварительно вносилась в 1 и 5 мл стерильного разбавителя соответственно. Во всех вариантах контроля посевы выполнялись в десятикратной повторности на каждой среде или подложке. Оценка ростовых свойств Petrifilm® СС и HSCC проводилась параллельно на каждой контрольной среде и с каждым контрольным штаммом. Для Petrifilm® ЕС оценка ростовых свойств выполнялась только на штамме E.coli М17-02 с одной контрольной средой (ПА).
Оценка ростовых и дифференцирующих свойств Petrifilm® СС и HSCC на пробах природной воды была выполнена путем параллельного определения показателя ОКБ на исследуемых тест-системах и среде Эндо с добавками. Исследование показателя проводилось в пятикратной повторности на каждой среде или подложке. Для исследования были использованы две пробы природной воды с низким и умеренным уровнем содержания ОКБ в 1мл пробы. Для каждого посева использовали 1 мл пробы. Посев на контрольную среду выполняли методом мембранной фильтрации. Для посева на Petrifilm® HSCC посевная доза предварительно вносилась в 4 мл стерильного разбавителя.
Для оценки дифференцирующих свойств все типичные колонии, выросшие в пяти повторностях на среде Эндо и каждой из тест-систем при исследовании двух проб, были идентифицированы на принадлежность к ОКБ согласно существующим методическим документам.
Оценка ростовых и дифференцирующих свойств Petrifilm® EС, ввиду отсутствия проб с достаточным уровнем контаминации E.coli в 1 мл пробы, была выполнена путем параллельного исследования проб природной воды, искусственно контаминированных суспензией эталонного штамма E.coli М17-02. Было выполнено два таких исследования в пятикратной повторности каждое.
Полученные результаты
Использование Петрифильмов действительно несложно, хотя и требует определенного навыка по внесению и распределению материала.
Обращает на себя внимание тот факт, что даже при самом аккуратном распределении пробы, после полимеризации геля часть пробы оказывается за пределами питательной среды на пенопластовой подложке. Рост микроорганизмов наблюдается и здесь. Цвет колоний можно оценить, но газообразования не видно. Согласно инструкции производителя такие колонии, которые располагаются вне зоны среды, учету не подлежат. Этот момент вызывает определенное недоумение. По нашим подсчетам, при оценке ростовых свойств Petrifilm® ЕС и СС на чистых культурах, вне зоны учета оказывалось в среднем около 10% колоний (от 5,6% до 17%). Данного недостатка лишены Petrifilm® HSCC. В этой тест-системе питательная среда располагается по всей площади подложки.
Что касается ростовых свойств, то результаты определения % всхожести (recovery rate) представлены в таблице 1.
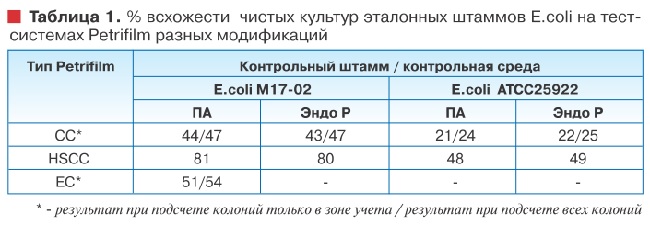
Petrifilm® ЕС и СС значительно ингибировали рост тестовых штаммов, особенно E.coli ATCC25922, даже при учете колоний, выросших вне зоны подсчета. Ростовые свойства тест-системы Petrifilm® HSCC оказались практически в два раза выше. Более того, для штамма E.coli М17-02 значения % всхожести достигли пороговых 80%. Правда, различие средних количеств колоний на исследуемой и контрольных средах, оцениваемое по критерию Стьюдента с вероятностью 95%, было достоверным.
При оценке ростовых свойств Petrifilm® СС и HSCC на пробах природной воды соотношение типичных колоний на среде Эндо и Петрифильмах обоих модификаций также было не в пользу последних - 61 и 66% по отношению к среде Эндо, соответственно для СС и HSCC. Для оценки дифференцирующих свойств изучаемых тест-систем была проведена идентификация в общей сложности 396 колоний.
После проведения идентификации ситуация разительно изменилась (таблица 2). % всхожести по показателю ОКБ для Petrifilm® CC составил 80%, а для Petrifilm® HSCC - 79%, по сравнению с 61 и 66% соответственно, полученных при учете типичных колоний. Причиной таких перемен послужил большой процент оксидазоположительных штаммов, дающих типичную морфологию на среде Эндо. Среди типичных колоний, попавших в идентификацию на среде Эндо, процент оксидазоположительных штаммов составил 18%, тогда как на Петрифильмах СС только 1%, а на Петрифильмах HSCC - 4%.
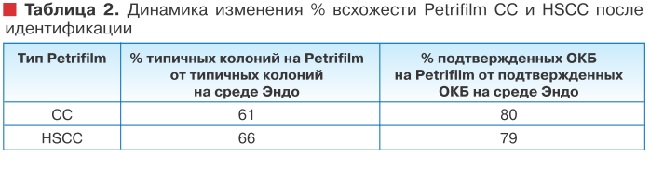
При этом 96% оксидазоположительных штаммов, дающих типичный рост на среде Эндо, сбраживали лактозу без образования газа. На Petrifilm® CC и HSCC такие штаммы изначально не попадали в учет, по той причине, что в этих тест-системах учету подлежат только колонии с признаками газообразования. Обратил на себя внимание еще один момент. Среди штаммов, образующих типичных колонии на Петрифильмах, был достаточно большой процент клонов вообще не утилизирующих лактозу. На Petrifilm® CC процент таких клонов составил 6% от всех типичных, а на HSCC - 12%. На среде Эндо штаммов, обладающих типичным ростом, но не сбраживающих лактозу, не было вообще.
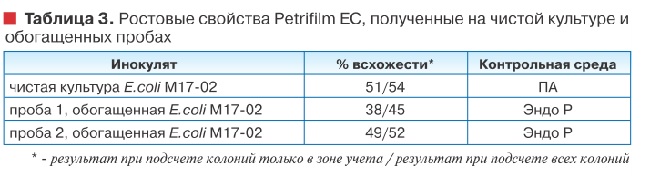
Исследование ростовых свойств Petrifilm® EC на пробах природной воды, обогащенных суспензией E.coli М17-02, в целом воспроизвело результаты, полученные при использовании чистых культур (таблица 3).
Обсуждение результатов
Принцип действия Petrifilm® CC и Petrifilm® HSCC, предназначенных для определения колиформных бактерий, понятен. В них использован модифицированный VRB агар (crystal Violet, neutral Red, Bile), аналог среды Мосселя с лактозой. Кристаллический фиолетовый и соли желчных кислот подавляют рост грамположительных микроорганизмов, а нейтральный красный служит индикатором, окрашивая колонии в розово-красный цвет при утилизации лактозы. При наличии газообразования вокруг колоний образуются легко заметные пузыри газа. Примечательно, что для определения колиформ в данной системе не используются хромогенные добавки для определения бета-галактозидазной активности. Не в силу ли их низкой специфичности?
То есть, по сути, CC и HSCC Petrifilm® это более простой способ использования традиционной среды с возможностью определения газообразования в первые 24-48 часов исследования. Petrifilm® EC предназначены как для определения ОКБ, так и для определения E.coli. Для определения кишечной палочки в вышеописанную систему для колиформ введена хромогенная добавка для выявления бета-глюкуронидазной активности. Благодаря этой добавке колонии эшерихий приобретают сине-фиолетовую окраску.
Очевидным недостатком Petrifilm®, который сразу привлекает внимание, является ограниченный и жестко лимитируемый объем исследуемой пробы – 1 мл. Следствием ограничения исследуемого объема является относительно низкая чувствительность метода. Принимая во внимание статистические правила учета результата, пределом обнаружения для тест-систем, исследующих 1 мл подготовленного образца, является 15 целевых КОЕ/мл образца. 15 КОЕ ОКБ в 1 мл равно 1500 КОЕ/100 мл. Такие уровни контаминации для проб воды являются достаточно высокими. Для примера, в очищенной сточной воде перед сбросом в реку уровень ОКБ не должен превышать 500 КОЕ/100 мл [7].
Выпуск формата HSCC является попыткой компании 3М расширить диапазон чувствительности Petrifilm® СС. Petrifilm® СС типичной компоновки предназначены для посева 1 мл пробы, тогда как Petrifilm® HSCC позиционируется как система с повышенной чувствительностью (Hi Sensitive), которая достигается за счет посева большего объема пробы (5 мл). Пятикратное повышение чувствительности делает возможным использование Petrifilm® HSCC для контроля качества очистки сточной воды или мониторинга водоисточников с высоким исходным уровнем микробного загрязнения.
Использование тест-систем действительно несложно, хотя и требует определенного навыка по внесению и распределению материала. Обращать внимание нужно, по меньшей мере, на два аспекта. Во-первых, при накатывании покровной пленки и распределении объема пробы по площади среды нужно избегать образования пузырей, которые впоследствии могут имитировать газообразование. Во-вторых, до момента застывания геля подложки нельзя наклонять даже незначительно, так как вода легко вытекает за пределы среды.
Ростовые свойства всех вариантов Petrifilm® исследованных партий существенно ниже, чем ростовые свойства среды Эндо даже с «речными» добавками. Только у Petrifilm® HSCC % всхожести на штамме E.coli M17-02 достиг уровня 80%, который регламентируется [6] как приемлемый при контроле сред, предназначенных для прямого посева. Однако при этом обязательным условием является недостоверность различия средних количеств колоний, выросших на контрольной и исследуемой средах. Такая высокая ингибирующая активность среды, используемой в Петрифильмах, возможно обусловлена расчетом на исследование образцов с большой контаминацией, присутствующей, например, в пищевых продуктах. Отчасти подтверждением тому является повышение процента всхожести до уровня 80% по показателю ОКБ для Petrifilm® CC при исследовании проб природной воды по сравнению с исследованиями суспензий чистых культур.
Отдельно хочется отметить высокую специфичность Petrifilm® CC и HSCC по отношению к оксидазоположительным лактозоположительным микроорганизмам. По этому параметру Петрифильмы исследуемых партий существенно превзошли среду Эндо.
Основой этой высокой специфичности, по нашему мнению, является уникальная возможность определения газообразования при сбраживании лактозы уже на этапе первичного инкубирования, так как большая часть идентифицированных оксидазоположительных микроорганизмов утилизировали лактозу только до кислоты без газа. Возможно, данная закономерность зависит от видового состава микробного сообщества и не будет воспроизводиться при исследовании воды других типов или регионов.
Интересен тот факт, что по существующим методическим документам в природной воде микробиолог при наличии достаточного опыта может осуществлять учет показателя ОКБ на среде Эндо без определения утилизации лактозы, а определение активности цитохромоксидазы проводить перекладывая мембранный фильтр на диск, смоченный реактивом [9]. При этом общеизвестно, что определить активность цитохромоксидазы таким способом у бактерий, дающих типичный для ОКБ рост на Эндо, практически невозможно.
Выводы:
Petrifilm® CC и HSCC позволяют определять газообразование из лактозы при первичной инкубации посевов в первые 24-48 часов, обладая при этом высокой специфичностью в отношении оксидазоположительных лактозоположительных микроорганизмов.
Ростовые свойства Petrifilm® CC, HSCC и ЕС изученных партий уступают ростовым свойствам среды Эндо по отношению к целевым микроорганизмам.
Залогом широкого внедрения Petrifilm® для санитарно-микробиологического контроля воды стала бы возможность использования мембранного способа посева при использовании данных тест-систем.
Необходимы дальнейшие исследования для определения возможности использования Petrifilm® в санитарном контроле воды.
Суммируя все вышесказанное, можно сказать, что применение тест-систем на подложках, использующих современные хромогенные среды, - перспективное направление развития современной санитарной микробиологии, для которой ускорение получения результата бактериологическим методом является жизненно важной проблемой.
Литература:
1. http://www.arrowscientific.com.au/com-ponent/page,shop.browse/option,com_virtuemart/Itemid,5/vmcchk,1/
2. http://www.dntpasteur.ru/manual1_31.php
3. http://www.ecwatech.ru/abstracts/2008/ 10/896.doc
4. http://www.hyserve.com/product_part. php?product=01
5. http://www.vostokbio.com/RIDACount.pdf
7. «Организация внутреннего контроля качества санитарно-микробиологических исследований воды». МУ 2.1.4.1057-01.
8. «Санитарно-микробологический анализ питьевой воды» МУК 4.2.1018-01.
9. «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов» МУК 4.2.1884-04.
Our own opinion on Petrifilm
Application of the test systems on substrates using modern chromogenic medium, are a promising direction of development of modern sanitary Microbiology, for which obtaining the result of the bacteriological method is a vital issue. In this work we compared the effectiveness of targeted sanitaryKindicative microorganisms of traditional culK ture methods with accelerated methods on substrates with chromogenic media. Shows lower sensitivity relative to traditional methods. To ensure continuity of the quantitative results, further studies are needed.
Keywords: total coliforms, production control, rapid methods.
Tymchuk Sergey Nikolaevich, Ph.D. (Medical), senior bacteriologist JSC «ROSA». 119297, Moscow, Spring street, the house 7, p. 35. Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Larin Vladimir Evgenyevich, Ph.D. (Biology), associate chief of the division of biological methods of analysis. JSC «ROSA». 119297, Moscow, Spring street, the house 7, p. 35. Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Журнал «Вода Magazine», №7 (95), 2015 г.
