УДК 579.262:574.52
Ключевые слова: природные биоценозы, микрофлора воды, биопленкообразование, антилизоцимная активность, качество воды.
В условиях развивающегося общества серьезной проблемой является качество воды. По оценкам ВОЗ, здоровье почти половины человечества находится под угрозой в связи с отсутствием безопасного водоснабжения либо с нерациональным использованием водных ресурсов. Потребление недоброкачественной воды связано с серьезными рисками для здоровья населения, повышая риск распространения инфекционных заболеваний. Одно из направлений, осуществляемых в рамках механизма «ООН - Водные ресурсы», сконцентрировано на поиске новых подходов мониторинга, обеспечивающих надежную оценку качества водоисточников.
Традиционно контроль за качеством воды опирается на микробиологические показатели, учитывающие общее микробное число, количество общих и термотолерантных колиформных бактерий [3]. Однако микроорганизмы, обитающие в природных водоемах, вовлеченные в сложные конкурентные или кооперативные взаимоотношения, существуют как члены обширных микробных сообществ. По сути, природные сообщества организмов представляют собой популяции хозяев с их симбионтами [8].
Микроводоросли способны самостоятельно продуцировать значительное количество слизи, что служит дополнительным источником развития матрикса и, в свою очередь, разрастания биопленки [4]. Известно, что в слизи микроводорослевых клеток сохраняются бактерии, поддерживающие свой персистентный потенциал, что обеспечивает им адаптацию к неблагоприятным условиям среды [4, 5].Таким образом, количественные показатели могут не всегда четко отражать адаптивные характеристики водной микрофлоры, что может негативно сказываться на показателях качества воды.
В результате многолетних исследований в качестве параметров, отражающих адаптивные возможности микроорганизмов, чутко реагирующих на изменение экологических условий среды, нами выбраны способность к биопленкообразованию и антилизоцимная активность [2].
Использование подобных параметров позволит наряду с количественными показателями (ОМЧ) оценить качественный состав микрофлоры, что существенно повысит надежность санитарной оценки качества природных и питьевых вод.
Цель работы - изучить параметры биопленкообразования и антилизоцимной активности микроорганизмов, характеризующие адаптивный потенциал биоты, для использования в оценке качества вод.
Материал и методы исследования
Биопленкообразование изучали у представителей автохтонной микрофлоры пресной воды питьевого назначения из артезианской скважины, полученной с глубины 120 метров.
Биопленки микроорганизмов получали хорошо известным и используемым в гидробиологии методом «пластинок обрастания» [10], для чего обезжиренные стерильные предметные стекла закрепляли в пластиковых креплениях и помещали в емкости с исследуемой природной водой.
Формирование биопленок наблюдали путем просмотра предметных стекол на разной стадии культивирования с использованием светового микроскопа Axiostar plus (K.Zeiss, Германия) с использованием фазово-контрастной микроскопии при увеличении х100 и х400. Для более детального изучения биопленок использовали иммерсионную фазово-контрастную микроскопию (ув. х1000). Для этого предметные стекла с биопленками аккуратно накрывали покровными стеклами. По мере необходимости производили выборочную фоторегистрацию с использованием цифровой фотокамеры Cannon Power Shot G5, соединенной с микроскопом.
В работе использованы изогенные штаммы Escherichia coli с антилизоцимной активностью и без таковой из музея ИКВС УрО РАН. Предварительная оценка не выявила цитотоксичности исследуемых штаммов эшерихий (вариант АЛА-) в тесте на аксенической культуре инфузорий Tetrachymena pyriformis, что обусловило возможность его использования для анализа взаимодействий с тетрахименами в качестве контроля. Трехсуточные бульонные культуры инфузорий в объеме 5 мл, содержащие 104 особей/мл, заражали изогенными штаммами E.coli (ALA+ опыт) и (ALA- контроль) в дозе 106 КОЕ/мл.
Опытные и контрольные образцы культивировали при 22-25°С. Учет результатов сокультивирования осуществляли на 1, 5, 10, 15, 20, 30 и 40 сутки эксперимента. Содержание лизоцима определяли фотонефелометрическим методом. Антилизоцимную активность бактерий определяли чашечным методом [1].
Результаты измерений обрабатывали статистически, с использованием программного обеспечения Microsoft Excel.
Результаты исследования и их обсуждение
Известно, что процесс образования биопленок протекает в несколько этапов: I - адгезия; II - образование монослоя; III - созревание I; IV – рост (созревание II); V - дисперсия (выброс бактерий) [4].
В результате проведенных исследований (рис. 1) на третьи сутки от начала эксперимента наблюдали взаимодействие микроорганизмов с поверхностью стекол.
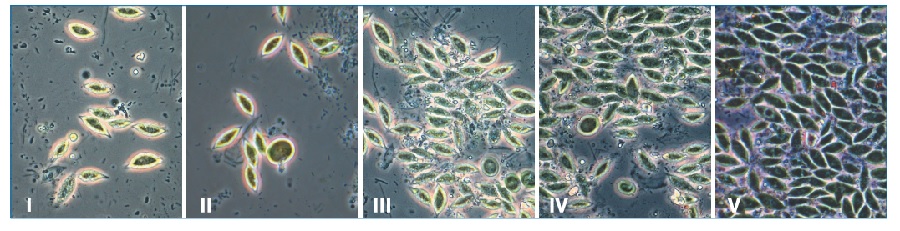
Кроме бактерий, в структуру биопленки встраивались клетки микроводорослей, входящих в состав аллохтонной микрофлоры. В связи с тем, что отсутствие света не позволяло им развиваться, процесс идентификации водорослей был затруднен. Поэтому стекла с обрастаниями в течение 6 часов выдерживали на свету.
После подращивания повторное микроскопическое исследование биопленок позволило установить, что микроводоросли в составе биопленки относятся к отделу Chlorophyta (зеленые), роду Scenedesmus. В природных условиях микроводоросли часто образуют биопленки. Описаны случаи обнаружения их в накопительных емкостях питьевой воды. Серьезную угрозу для здоровья человека представляют виды, способные к токсинообразованию [6]. К 13 суткам наблюдалось разрастание биопленок. В их составе наблюдали присутствие жгутиковых простейших.
К 16 суткам процесс биопленкообразования достигал своего максимального развития, наблюдались «очаги» новообразования биопленок. В составе обрастаний появлялись мелкие инфузории. Процесс взаимодействия простейших с биопленками обсуждается. Поскольку бактерии служат для них основной пищей, то в ряде случаев их значение оценивается в качестве регулирующего механизма, направленного на ограничение роста биопленки [7].
Биопленки, заключенные в межклеточный матрикс на границе раздела «твердая поверхность - вода», могут являться своеобразной мишенью для встраивания санитарно-показательных, условно-патогенных и патогенных микроорганизмов. Это существенным образом может ухудшать санитарные показатели воды [6; 9], служа постоянным источником поступления патогенов в систему водоснабжения.
На следующем этапе исследований в условиях экспериментального сокультивирования аксенической культуры инфузорий Tetrahymena pyriformis с изогенной парой E.coli (АЛА -) и (АЛА +) показано влияние лизоцим-антилизоцимных взаимодействий на развитие ассоциативных связей в системе «простейшее-бактерия». В опытных образцах концентрация кишечных палочек (вариант АЛА+) в первые сутки снизилась до 104 КОЕ/мл с последующим подъемом на 14-е сутки до 105 КОЕ/мл.
К 21 суткам численность E.coli (АЛА+) установилась на уровне 104 КОЕ/мл и сохранялась до конца эксперимента.
В контрольных образцах численность кишечных палочек (вариант АЛА-) в первые сутки снизилась с 107 КОЕ/мл до 8.102 КОЕ/мл, к седьмым суткам - до 102 КОЕ/мл, а к 28 суткам -101 КОЕ/мл.
На 35 сутки они перестали выделяться из образцов, что, по-видимому, связано с их полным «выеданием» простейшими. Численность инфузорий во всех опытных образцах до начала эксперимента была 103 - 104 особей/мл и сохранялась на этом уровне до конца эксперимента. Содержание эндогенного лизоцима простейших в контрольных образцах колебалось от 1,19+0,06 мкг/мл в начале опыта до 0,8+0,10 мкг/мл к концу наблюдений.
Сходное количество мурамидазы (1,2+0,06 мкг/мл - 0,7+0,10 мкг/мл) регистрировалось и у интактных простейших. Контроль антилизоцимной активности у эшерихий (АЛА-) в ассоциации с тетрахименами давал отрицательные результаты на протяжении всего срока эксперимента.
Эффект длительного сохранения бактерий при взаимодействии с простешими в биопленке также наблюдали другие исследователи на экспериментальной модели Tetrahymena pyriformis с бактериями Burkholderia cepacia [7].
У простейших, сокультивировавшихся с антилизоцимактивным вариантом кишечных палочек, уровень эндогенного лизоцима снижался гораздо сильнее - до 0,2+0,01 мкг/мл к 14 суткам. С 21 суток до окончания эксперимента эндогенный лизоцим у простейших уже практически не обнаруживался. При наличии в отобранных пробах живых активных простейших выявленный факт может свидетельствовать о нейтрализации лизоцима простейших с помощью антилизоцима бактерий.
Исследование гетерогенности популяции эшерихий по уровню антилизоцимного признака в процессе сокультивирования выявило увеличение доли субклонов с высоким уровнем антилизоцимной активности (рис. 2).
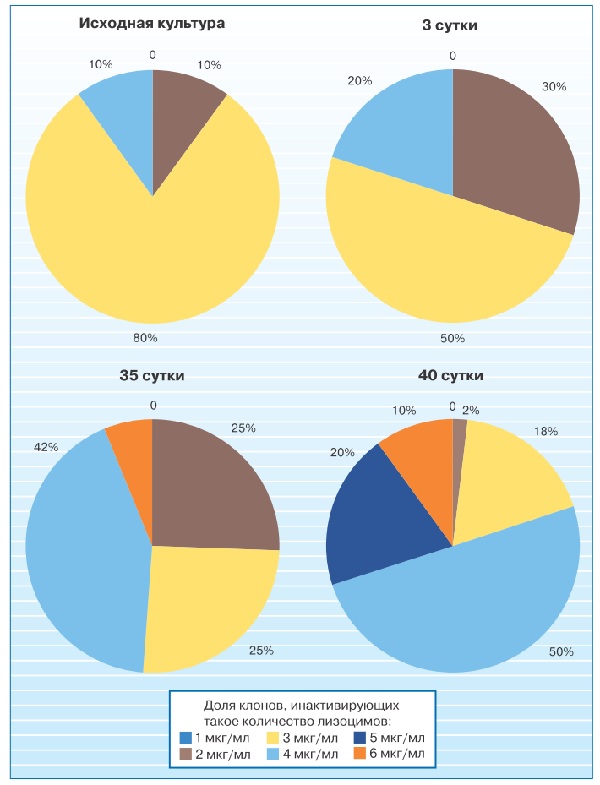
Полученные данные расширяют рамки традиционных представлений об антилизоцимной активности микроорганизмов только как о факторе персистенции патогенных микроорганизмов в организме человека. Есть все основания считать этот признак важной составной частью универсального механизма регуляции биоценотических взаимоотношений микроорганизмов в природных сообществах. В частности, с помощью лизоцим-антилизоцимных связей могут осуществляться симбиотические взаимодействия микроорганизмов.
В результате микробиологического исследования качества питьевой воды в процессе водоподготовки выявлено, что количество бактерий в воде, прошедшей песчано-гравийный фильтр, сократилось в четыре раза, а угольно-сорбционный - в пять раз по сравнению с водой отстойника. До потребителя доходят не более 10% бактерий от первоначального микробного уровня. Приблизительно в 90 раз снижается количество диатомовых и в 2- 2,5 раза - эвгленовых и зеленых водорослей (рис. 3).
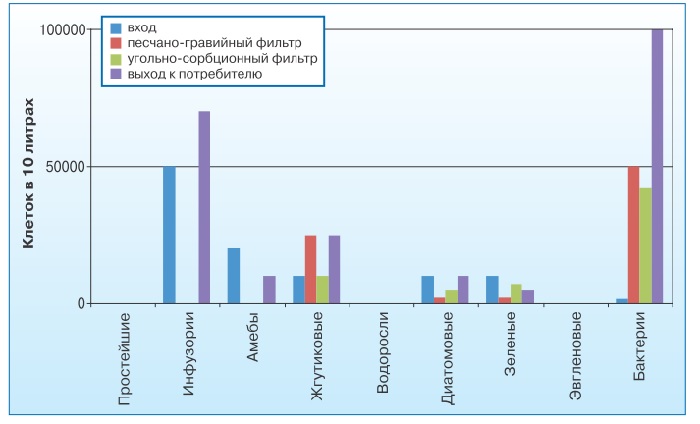
На фоне постепенного сокращения количества водорослевых и протозойных клеток в воде, а также снижения уровня микробной обсемененности в воде, дошедшей до потребителя, сохраняется достаточно высокое содержание простейших, а также диатомовых и зеленых водорослей.
Одновременно со снижением бактериальной контаминации воды в процессе водоподготовки выявлено нарастание количества штаммов, обладающих высоким персистентным потенциалом (рис. 4).
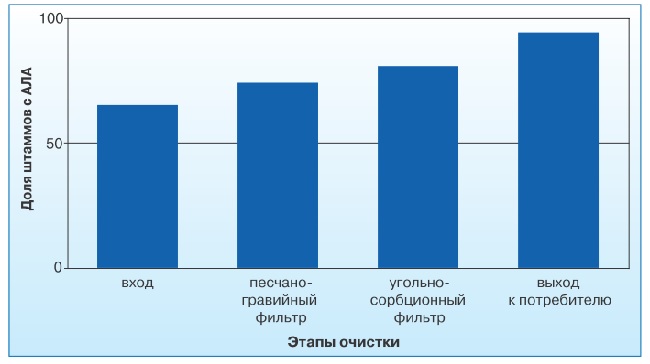
Здесь обнаруживали Pseudomonas spp., Enterobacter spp., Escherichia spp., Citrobacter spp., Aeromonas spp. и Proteus spp. У всех изолированных на этом этапе культур зарегистрировано наличие антилизоцимной активности.
Накопление подобных бактериальных культур, вероятно, можно объяснить формированием симбиотических связей с водорослями и простейшими. Как известно, бактерии успешно преодолевают барьер фильтрационных сооружений, находясь в слизистых чехлах водорослей или в фагосомах простейших. При этом совершенно не важна жизнеспособность гидробионтов, потому что даже погибшие простейшие способны влиять на динамику клеточной активности бактерий, ухудшая санитарное качество воды.
Приведенные материалы свидетельствуют, что способность к биопленкообразованию, а также антилизоцимная активность, являясь механизмами выживания и адаптации бактерий, участвуют в регуляции сложного ансамбля симбиотических взаимодействий гидробионтов.
С биологической точки зрения сохранение антилизоцимактивных штаммов микроорганизмов в питьевой воде свидетельствует об их большей адаптивной пластичности по сравнению с микроорганизмами, не обладающими данным признаком. С другой стороны, антилизоцимный признак создает преимущество патогенам при взаимодействии с макроорганизмом, что продемонстрировано рядом исследователей при экспериментальной инфекции на животных и при анализе инфекционной патологии людей [1].
В итоге, с точки зрения санитарии, явление накопления подобных штаммов в процессе водоподготовки свидетельствует о недостаточном качестве воды.
Выводы
В системе санитарно-экологического мониторинга при осуществлении динамического контроля за качеством природных и питьевых вод наряду с количественными показателями необходимо привлекать качественные параметры. Свойства микроорганизмов, такие как способность к биопленкообразованию, а также антилизоцимная активность, принимающие участие в развитии симбиотических связей, могут служить дополнительным критерием качества среды. Использование подобных показателей позволит оперативно принимать управленческие решения по оптимизации водопользования как важного этапа процесса ресурсосбережения России.
Литература:
1. Бухарин О.В. Персистенция патогенных бактерий. М.: Медицина, 1999. 367 с. 2. Бухарин О.В., Лобакова Е.С., Немцева Н.В., С.В. Черкасов Ассоциативный симбиоз, Екатеринбург: УрО РАН, 2007. 264 с.
3. СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. М.: Минздрав, 2002.
4. Costerton J.W., Lewandowski Z., Caldwell E., Korber D. R. Lappin-Scott H.M. Microbial Biofilms. Annu. Rev. Microbial. ,1995. V. 49. P.711-745
5. Decho A. W. The EPS Matrix as an Adaptive Bastion for Biofilms: Introduction to Special Issue // Int. J. Mol. Sci. ,2013, V.14. №12. P. 2329723300
6. Ignatenko A.V. Study of biofilm formation of bacteria and evaluation of their resistance to biocides // Proceedings of BSTU. Series 4: Chemistry, technology of organic substances and biotechnology. Minsk, 2008. V. XVI. P. 173-176.
7. Kaminskaya AA, Pushkareva VI, Ermolaeva SA, Stepanova TV, Alekseeva NV, Andreev AL The role of the association of protozoans Tetrahymena pyriformis and bacterium Burkholderiacepacia in the formation of biofilms // Advances in modern biology. 2007. V.127, № 1. P. 44-47
8. Lakaniemi AM, Hulatt C.J., Wakeman K.D. Thomas D.N. Puhakka J.A. Eukaryotic and prokaryotic microbial communities during microalgal biomass production // Bioresours Technology, 2012. V. 124. P. 387-393
9. Pavlova I.B, AntonovaA.N., Lenchenko E.M. Investigation of the information of biofilms by pathogenic bacteria // Problems of veterinary sanitation, hygiene and ecology. 2016. V.18, №2. P 63-70.
10. Rodina A.G. Methods of aquatic microbiology. Practical guidance. M., L.: Science. 1965. 363 p.
11. Decho A. W. The EPS Matrix as an Adaptive Bastion for Biofilms: Introduction to Special Issue // Int. J. Mol. Sci. ,2013, V.14. №12. P. 23297-23300
12. Flemming H.C., Wingender J. The biofilm matrix. Nature Reviews Microbiology. 2010. № 8. P. 623-633
13. Ignatenko A.V. Study of biofilm formation of bacteria and evaluation of their resistance to biocides // Proceedings of BSTU. Series 4: Chemistry, technology of organic substances and biotechnology. Minsk, 2008. V. XVI. P. 173-176.
14. Kaminskaya A.A, Pushkareva V.I, Ermolaeva S.A, Stepanova T.V, Alekseeva N.V, Andreev A.L. The role of the association of protozoans Tetrahymenapyriformis and bacterium Burkholderiacepacia in the formation of
biofilms / / Advances in modern biology. 2007. V.127, № 1. P. 44-47
15. Lakaniemi AM, Hulatt C.J., Wakeman K.D. Thomas D.N. Puhakka J.A. Eukaryotic and prokaryotic microbial communities during microalgal biomass production // Bioresours Technology, 2012. V. 124. P. 387393
16. Pavlova I.B, Antonova.A.N., Lenchenko E.M Investigation of the formation of biofilms by pathogenic bacteria // Problems of veterinary sanitation, hygiene and ecology. 2016. V.18, №2. P 63-70.
17. Rodina A.G. Methods of aquatic microbiology. Practical guidance. M., L.: Science.1965. 363 p.
18. Zilber-Rosenberg I., Rosenberg E. Role of microorganisms in the evolution of animals and plants: the hologenome theory of evolution// FEMS Microbiol. Rev., 2008. V. 32, № 5. P. 723-735.
Biofilm formation and antilysozyme activity of microorganisms as the quality criteria of natural and drinking waters
This article includes the results of experimental research. The ability of microorganisms to biofilm formation and their antilysozyme activity can serve as reliable hallmark of water quality. These activities provide the development of symbiotic relationships between bacteria with algae and protozoa. The results can be used in the development of new monitoring approaches providing reliable assessment of the water sources quality.
Keywords: biocenosis, microflora of water, biofilm formation, antilysozyme activity, water quality.
Nemtseva Nataliya Vyatcheslavovna, Doctor of medical sciensies, Professor, Head oft he Aquatic Microbiology Laboratory. Institute of Cellular and Intracellular Symbiosis UD RAS, Orenburg, Pionerskaya str.,11, Russia. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Bukharin Oleg Valeryevich, Academician of RAS, Doctor of medical sciensies, Professor, Chief Researcher. Institute of Cellular and Intracellular Symbiosis UD RAS, Orenburg, Pionerskaya str.,11, Russia. E-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Журнал «Вода Magazine», №4 (128), 2018 г.
